Вы здесь
6.1. Определение, этиология и патогенез
Глава 6. Судебно-медицинская оценка хронических субдуральных гематом
СГ относят к хроническим в том случае, если они обнаружены или удалены уже после своей инкапсуляции. Сроки инкапсуляции СГ зависят от многих факторов и характеризуются выраженной вариабельностью. Поэтому в литературе предлагается относить к хроническим гематомы различной давности: от 1 недели до 3 месяцев [31,599,600]. Все же большинство авторов считает, что обычно капсула может быть обнаружена уже спустя 2 недели после кровоизлияния в субдуральное пространство, и именно этот срок чаще всего используют для разграничения подострых и хронических СГ [599]. Соответственно к подострым относят гематомы, диагностированные в срок от 3-х до 14-ти суток после своего образования, а к острым – гематомы, обнаруженные в первые трое суток своего существования [599]. Под обнаружением гематомы подразумевается ее клиническая манифестация с развитием симптомов церебральной компрессии.
Хронические СГ представляют собой полиэтиологическую патологию. Принципиально множества этиологических факторов и источников хронических СГ по объему и перечню элементов не отличаются от таковых неинкапсулированных субдуральных кровоизлияний. Аналогично последним наиболее частой причиной хронических СГ является ЧМТ [103,601]. В качестве следующих по частоте этиологических факторов в специальной литературе называются арахноидальные кисты [165,173,174], геморрагические состояния [143,145,146], в том числе вызванные приемом антикоагулянтов [151,286,300], первичная и метастатическая опухолевая патология ГМ и церебральных оболочек [208,212,214,216,223], кранио-церебральные диспропорции, включая возрастную церебральную атрофию [126,602,603], ятрогенные осложнения различных лечебных и диагностических медицинских манипуляций [247,248,253,257,263,295].
Развернутая классификация хронических СГ включает множество кластерообразующих признаков, часть из которых аналогична классификационным схемам неинкапсулированных гематом. Таковыми являются: этиология, локализация по отношению к отросткам ТМО и поверхностям ПБМ и мозжечка, объем и фазность клинического течения. Дополнительно хронические СГ подразделяются по строению, регистрируемой методами КТ или МРТ плотности и по темпу клинического течения [31,38].
Хронические СГ относятся к патологическим состояниям, которым уделяется много внимания. Тем не менее, патогенез хронических СГ по-прежнему остается предметом дискуссий. В частности, не до конца понятными остаются причины отсроченной клинической манифестации и персистенции хронических СГ.
Основными исходами эволюции СГ любого генеза, в том числе и травматических, являются развитие сдавления и дислокации ГМ, организация с частичной или полной резорбцией и инкапсуляция с последующей персистенцией [604]. При этом один из исходов, проявляющийся инкапсуляцией и персистенцией гематомы, является облигатно нестабильным и при неограниченной пролонгации сроков своего существования сопровождается обязательным переходом в одно из двух основных альтернативных состояний (рис. 93).
Согласно изложенным в разделе 4.5 результатам собственных исследований, основными факторами, определяющими сроки развития дислокации ГМ и, следовательно, вариант клинического течения и исход СГ при НЧМТ, являются два показателя: объем субдурального кровоизлияния и его ассоциация с иной внутричерепной травматической патологией. Большой объем и ассоциация с ОПГМ и СК определяют острое течение СГ с развитием дислокации ГМ при отсутствии своевременного медицинского вмешательства. Напротив, небольшой объем гематомы и отсутствие сопутствующей внутричерепной травматической патологии способствуют бессимптомному клиническому течению НЧМТ с последующей резорбцией СГ без развития церебральной дислокации. Однако малопонятными остаются причины и механизм формирования подострых и хронических СГ. В связи с этим автором была предпринята попытка определения причин, сроков и механизмов формирования подострых и хронических СГ.
Согласно данным литературы, острое течение СГ характерно для тяжелой ЧМТ, а подострое и особенно хроническое – для относительно легкой травмы [599,603,605]. Аналогичные выводы были получены при анализе 409 собственных наблюдений НЧМТ с наличием СГ различных сроков клинической манифестации (табл. 41).
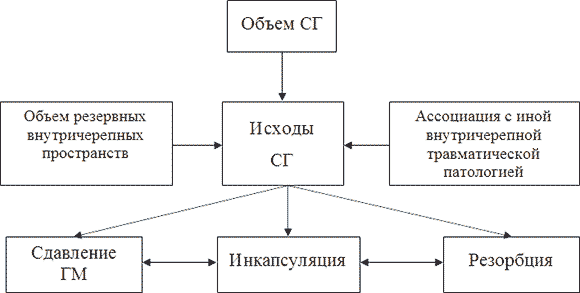
Рис. 93. Основные исходы СГ при НЧМТ и их причины.
Таблица 41 Точечные и 95% интервальные оценки частот ассоциаций повреждений головы с различными видами СГ при НЧМТ
| Показатель | Эпичерепные повреждения | Переломы черепа | СК | ОПГМ | |
| Острые СГ n = 367 | πL | 0,937 | 0,454 | 0,933 | 0,754 |
| \[\hat p\] | 0,962 | 0,507 | 0,959 | 0,798 | |
| πU | 0,979 | 0,559 | 0,977 | 0,838 | |
| Подострые и хронические СГ n = 42 | πL | 0,529 | 0,040 | 0,554 | 0,298 |
| \[\hat p\] | 0,690 | 0,119 | 0,714 | 0,452 | |
| πU | 0,824 | 0,256 | 0,843 | 0,613 | |
| δ | 0,271 | 0,388 | 0,245 | 0,346 | |
| р | 0,00001 | 0,00001 | 0,00001 | 0,00001 | |
Приведенные в таблице 41 результаты подтверждают, что важнейшим условием, определяющим подострый или хронический вариант течения СГ при НЧМТ, является отсутствие или слабая выраженность ассоциированных с СГ внутричерепных повреждений.
Несмотря на то, что хронические СГ возникают во всех возрастных периодах, в том числе и антенатально, возраст пострадавших относят к числу важных факторов, определяющих клиническое течение СГ [600,602,606]. Это объясняется тем, что возможность развития и сроки компрессии мозга СГ определяются разностью между объемами полости черепа и нелабильных внутричерепных структур, которая увеличивается с возрастом.
В целях количественного описания возрастной динамики объемов нелабильных внутричерепных структур автором было произведено измерение объемов ГМ и ТМО, а также массы ГМ у трупов 61 мужчины и 32 женщин, умерших в возрасте от 18 до 92 лет. В исследование не включались трупы лиц с наличием травматических или каких-либо других патологических изменений черепа и внутричерепных структур, кроме атеросклероза артерий ГМ при отсутствии его инфарктов и внутримозговых кровоизлияний любого объема и давности. Для исключения возможного влияния каких-либо медицинских вмешательств (инфузионная терапия, реанимационные мероприятия) в исследование также не включались лица, смерть которых наступила в стационаре.
Определение объемов ТМО и ГМ осуществляли путем погружения указанных анатомических структур в воду с последующим измерением объема вытесненной ими воды. Относительная погрешность измерения объема ГМ не превышала 0,5%, объема ТМО – 3%. Относительная погрешность измерения веса ГМ не превышала 1%.
Корреляционный анализ выявил наличие умеренной отрицательной возрастной динамики объемно-весовых показателей ГМ и отсутствие значимого влияния возраста на объем ТМО (табл. 42).
Таблица 42 Характер возрастной динамики объемно-весовых показателей ГМ и ТМО
| Параметры | n | r | t | p | |
| Масса ГМ | Мужчины | 61 | -0,371 | -3,073 | 0,003 |
| Женщины | 32 | -0,484 | -3,031 | 0,005 | |
| Объем ГМ | Мужчины | 61 | -0,341 | -2,785 | 0,007 |
| Женщины | 32 | -0,417 | -2,512 | 0,018 | |
| Объем ТМО | Мужчины | 61 | 0,131 | 1,019 | 0,312 |
| Женщины | 32 | -0,091 | -0,502 | 0,620 | |
С целью проверки возможного наличия межполовых различий в возрастной динамике было произведено сравнение оцененных у мужчин и у женщин коэффициентов корреляции исследовавшихся объемно-весовых параметров с возрастом. Сравнительный анализ значимых межполовых различий в скорости развития церебральной атрофии и возрастной динамике объема ТМО не обнаружил (табл. 43). Это позволило рассчитать для каждого объемно-весового показателя совместный коэффициент корреляции и вычислить его интервальные оценки (табл. 44).
Таблица 43 Чувствительность межполовых сравнений возрастной динамики объемно-весовых показателей ГМ и ТМО
| Параметр | р | 1 - β | 1 – β при n1 = n2=200 |
| Масса ГМ | 0,544 | 0,10 | 0,28 |
| Объем ГМ | 0,697 | 0,07 | 0,14 |
| Объем ТМО | 0,330 | 0,17 | 0,60 |
Таблица 44 Совместные оценки возрастной динамики объемно-весовых показателей ГМ
| Показатель | 95% нижняя | Точечная | 95% верхняя | |
| Масса | r | -0,225 | -0,413 | -0,568 |
| r2 | 0,051 | 0,171 | 0,323 | |
| Объем | r | -0,176 | -0,367 | -0,533 |
| r2 | 0,031 | 0,137 | 0,284 | |
Таким образом, закономерным проявлением процессов старения является церебральная инволюция, сопровождающаяся нарастающим снижением массы и объема ГМ.
Регрессионный анализ показал, что зависимости объемно-весовых показателей ГМ от возраста на промежутке 18-100 лет по форме являются линейными и могут быть адекватно представлены следующими аналитическими выражениями:
${V_M} = 1428,199 - 3,178A \pm 134,410 \cdot {t_{\alpha ;59}} \cdot \sqrt {1,016 + \frac{{{{(A - 49,867)}^2}}}{{13881,014}}}$ и
\[{V_W} = 1264,460 - 2,747A \pm 101,407 \cdot {t_{\alpha ;30}} \cdot \sqrt {1,031 + \frac{{{{(A - 56,382)}^2}}}{{8598,286}}} \]
где VM – церебральный объем у мужчин, мл; VW – церебральный объем у женщин, мл; А – возраст, лет; t – значение двустороннего варианта t-критерия при требуемом уровне значимости α и указанном количестве степеней свободы.
Полученные регрессионные модели свидетельствуют, что к 80 годам дефицит объема ГМ в среднем равен 14% и в абсолютных числах составляет 191 мл у мужчин и 165 мл у женщин. Указанные результаты согласуются с данными других авторов, изучавших динамику возрастной церебральной атрофии [607]. Учитывая данные литературы о незначительных возрастных изменениях объема полости черепа [608] и доказанное в настоящем исследовании отсутствие клинически и статистически значимой возрастной динамики объема ТМО, можно утверждать, что возрастное увеличение реального и резервного объемов субдурального пространства примерно соответствует инволюционному дефициту объема ГМ. Наличие резервного объема субдурального пространства объясняется частичной компенсацией возрастного дефицита объема ГМ развитием наружной и внутренней гидроцефалии.
Изложенное позволяет прогнозировать, что объем СГ, необходимый для развития сдавления и дислокации ГМ, должен умеренно (p≈0,37) зависеть от возраста пострадавшего, равномерно нарастая по мере увеличения последнего. Также должна иметь место положительная зависимость длительности светлого промежутка при НЧМТ с наличием СГ от возраста пострадавшего. Вместе с тем, в исследованиях, изложенных в разделах 4.4 и 4.5, такие зависимости обнаружены не были. Это объясняется тем, что самым важным фактором, определяющим развитие сдавления и дислокации ГМ и маскирующим влияние всех остальных особенностей НЧМТ и пострадавшего, является ассоциация СГ с иной внутричерепной травматической патологией. Поэтому выявить влияние возраста пострадавшего на объем смертельных СГ и на сроки клиничес кой манифестации последних можно только путем стратификации выборок.
С учетом изложенного был осуществлен анализ зависимости объема смертельных изолированных супратенториальных СГ и гематом аналогичной локализации, но ассоциированных с СК, не выходящими за пределы одного полушария большого мозга, мозжечка или ствола мозга, от возраста пострадавшего. При исключении маскирующих влияний корреляционный анализ 96 наблюдений доказал наличие искомой зависимости (r=0,301; t=2,119, p=0,040), примерно соответствующей динамике возрастной церебральной инволюции по силе, но противоположной по знаку. Также при исследовании 47 гематом, не ассоциированных с ОПГМ, была обнаружена умеренная положительная зависимость светлого промежутка их клинического течения от возраста пострадавшего (rS=0,346; t=3,580;p=0,001).
Для оценивания рисков клинической манифестации хронических СГ в различные сроки НЧМТ был применен анализ выживаемости по методу Каплана-Мейера, который основывался на ретроспективных данных 63 наблюдений подострых и хронических СГ с известными сроками причинения НЧМТ и развития грубой клинической декомпенсации. В качестве полных рассматривались наблюдения с клинико-инструментальными проявлениями фазы грубой декомпенсации, а в качестве цензурированных справа – с отсутствием таковых.
Анализ выживаемости показал, что кумулятивная вероятность клинической манифестации хронических СГ максимальна в срок до 25 суток после причинения НЧМТ. Спустя 25 суток данная вероятность менее 20% и к 70 суткам посттравматического периода приближается к 10% (рис. 94). Следовательно, отсутствие церебральной компрессии к концу трех месяцев после причинения НЧМТ означает либо отсутствие, либо завершенную организацию СГ. Отсюда трехмесячный срок наблюдения за динамикой посттравматического периода является критическим, после которого клиническая манифестация хронической СГ становится маловероятной.
Важной особенностью хронических СГ является их способность к самостоятельному увеличению своего объема. Основной причиной увеличения объема хронических СГ считаются повторные кровоизлияния в капсулу гематомы [609]. Указанные кровоизлияния инфильтрирующего характера, локализованные вокруг синусоидных капилляров, являются характерной чертой строения капсул резорбированных и инкапсулированных СГ (см. рис. 39,40). В части капсул указанные кровоизлияния принимают характер густой эритроцитарной инфильтрации с расслоением капсулы СГ. Вследствие этого капсулы многих СГ имеют стратифицированный характер за счет чередования слоев грануляций со слоями свежей геморрагической имбибиции. Признаки стратификации часто определяются также в капсулах резорбированных СГ большой давности и при отсутствии вторичных интракапсулярных геморрагий в виде слоистого расположения скоплений внеклеточного гемосидерина.
Вероятность развития вторичных кровоизлияний в резорбированных и инкапсулированных СГ максимальна в момент начала инкапсуляции гематом, после чего монотонно снижается, не достигая нуля (рис. 95). Даже спустя 2 года после причинения НЧМТ указанная вероятность составляет 33%. Однако в первые 3 месяца существования СГ указанные кровоизлияния характеризуются максимальной вероятностью развития (75-85%), отличаются наибольшей интенсивностью, часто имеют расслаивающий характер. Спустя 3 месяца содержимое СГ обычно подвергается полной резорбции, вторичные геморрагии встречаются с меньшей вероятностью, преимущественно имея характер мелкоочаговых кровоизлияний небольшой интенсивности, состоящих их рыхло расположенных эритроцитарных масс.
В целях изучения механизмов формирования хронических СГ был осуществлен сравнительный анализ количественных показателей капсул резорбированных СГ, разделенных на 2 группы. Первую группу (n1 = 5) образовали резорбированные СГ, клиническое течение которых на всем своем протяжении характеризовалось отсутствием проявлений фазы грубой клинической декомпенсации, несмотря на то, что все указанные гематомы были ассоциированы с СК и/или ОПГМ. Вторую группу (n2 = 11) составили резорбированные гематомы, клиническое течение которых сопровождалось развитием грубой клинической декомпенсации спустя 14 суток после причинения НЧМТ.
Дескриптивное оценивание показало, что капсулы хронических резорбированных СГ при схожей давности отличаются от капсул бессимптомных резорбированных СГ большим относительным объемом сосудистого компонента, большей долей клеточных популяций воспалительного генеза, большей толщиной, меньшим относительным объемом гемосидероза и меньшей долей соединительнотканных клеток (табл. 45). Однако из всех межгрупповых различий только различие толщины капсул являлось весьма выраженным (δ = 640 мкм) и оказалось статистически значимым (U = 12,5; p = 0,015).
Таблица 45 Характеристика капсул различных типов резорбированных СГ
| Показатель | Бессимптомные СГ (n1 = 5) | Хронические СГ(n2 = 11) | \[\delta \bar x\] | U | p | ||
| \[{\bar x_1}\] | s1 | \[{\bar x_2}\] | s2 | ||||
| t, сутки | 405 | 156,8 | 328,9 | 328,4 | -76,1 | 22 | 0,533 |
| VV | 0,052 | 0,037 | 0,15 | 0,177 | 0,098 | 25 | 0,777 |
| VC | 0,078 | 0,008 | 0,066 | 0,048 | -0,012 | 15 | 0,157 |
| VH | 0,034 | 0,053 | 0,021 | 0,031 | -0,013 | 22 | 0,533 |
| NN | 0,007 | 0,009 | 0,066 | 0,102 | 0,059 | 19 | 0,336 |
| NM | 0,019 | 0,043 | 0,055 | 0,09 | 0,036 | 22 | 0,533 |
| NL | 0,029 | 0,048 | 0,044 | 0,047 | 0,015 | 22 | 0,533 |
| NF | 0,946 | 0,063 | 0,835 | 0,198 | -0,111 | 16,5 | 0,213 |
| L, мкм | 96 | 41,4 | 735,5 | 654,9 | 639,5 | 6 | 0,015 |
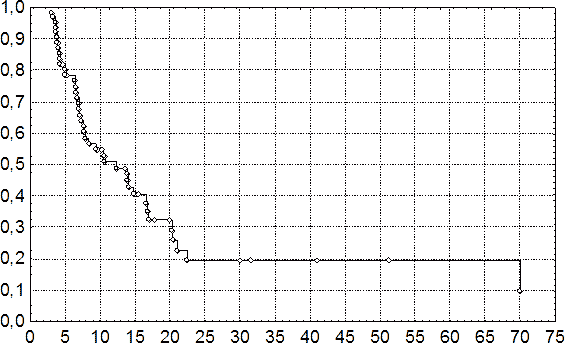
Рис. 94. Кумулятивная вероятность клинической манифестации хронических СГ в различные сроки посттравматического периода. По оси абсцисс – давность НЧМТ, сутки; по оси ординат – вероятность переживания. Знак ○ означает полные, а знак ◊ - цензурированные наблюдения.
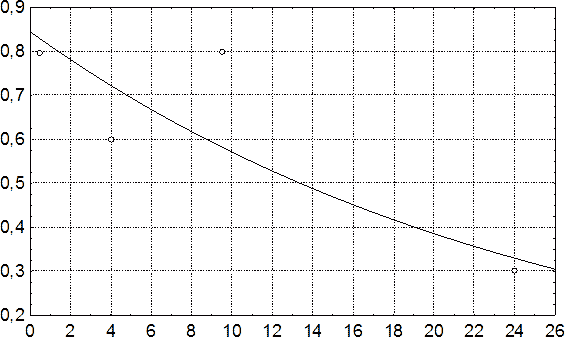
Рис. 95. Вероятность вторичных кровоизлияний в капсулу СГ в различные сроки посттравматического периода. По оси абсцисс – давность НЧМТ, месяцы; по оси ординат – вероятность вторичных интракапсулярных кровоизлияний. Знаком ○ маркированы точечные оценки доли СГ с наличием вторичных интракапсулярных кровоизлияний на данном временном промежутке.
Согласно номограмме определения риска дислокации ГМ (см. раздел 4.5), первичный объем каждой из бессимптомных резорбированных СГ не превышал 50 мл. Отсюда следует, что резорбция СГ малого объема завершается образованием капсулы, распределение толщины которой соответствует распределению данного показателя бессимптомных резорбированных СГ.
Статистический анализ показал, что функция плотности вероятностей толщины капсул бессимптомных СГ адекватно аппроксимируется
\[({\chi ^2} = 15,609;\nu = 12;p = 0,210;D = 0,262;p > 0,1)\]
логнормальным распределением с параметрами формы и масштаба µ1=4,48589348 и σ1=0,454119074 (рис. 96). Функция плотности вероятностей толщины капсул хронических резорбированных СГ также наиболее адекватно
\[({\chi ^2} = 13,960;\nu = 9;p = 0,124;D = 0,190;p > 0,1)\]
аппроксимировалась логнормальным распределением, но с параметрами µ2=6,11319630 и σ2=1,17978166 (см. рис. 96).
Тогда математическое ожидание и медиана толщины капсул бессимптомных резорбированных СГ малого объема и резорбированных хронических СГ могут быть определены как:
M(x1)=98,4 мкм, M(x2)=906,1 мкм; Me1=88,8 мкм, Me2=451,8 мкм.
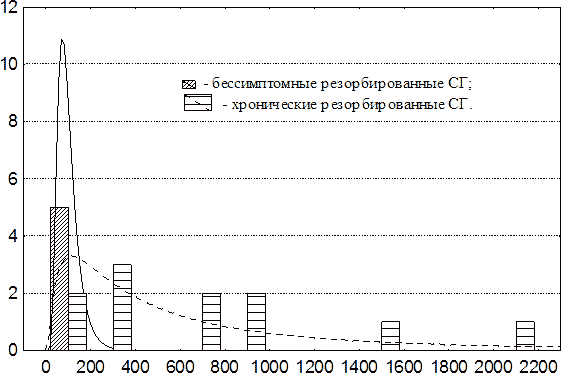
Рис. 96. Гистограммы толщины капсул резорбированных бессимптомных и хронических СГ. По оси абсцисс – толщина капсулы, мкм; по оси ординат – количество наблюдений. Линией показаны функции плотностей вероятностей семейства аппроксимирующих логнормальных распределений.
Помимо толщины капсулы резорбированные бессимптомные и хронические СГ значимо отличались также частотой вторичных интракапсулярных кровоизлияний (р = 0,026). Указанные геморрагии в гематомах первой группы отсутствовали, а в гематомах второй группы наблюдались в 72% (8) наблюдений.
Следует подчеркнуть, что сравнительный анализ бессимптомных и хронических СГ проводился на этапе их резорбции спустя значительное время после их образования. В этой связи отсутствие значимых различий относительных объемов различных структурных компонентов и долей популяций клеточного инфильтрата капсул указанных гематом отнюдь не свидетельствует о небольшой величине первых в момент формирования хронических СГ. Ведь даже в случае большой величины указанных различий последние были минимизированы дальнейшей эволюцией капсул СГ, направленной на уменьшение относительного объема сосудистого компонента и уменьшение интенсивности воспалительной клеточной инфильтрации. Анализ исследовавшихся морфометрических показателей показывает, что относительно стабильными из них после резорбции жидкого содержимого СГ являются толщина ее капсулы и относительный объем гемосидероза. Все остальные анализировавшиеся показатели являются нестабильными и, следовательно, в какой-то мере были изменены. Анализ же стабильных показателей выявил резкое различие бессимптомных и хронических СГ по толщине и отсутствие значимых различий по относительному объему гемосидероза их капсул.
Таким образом, совокупность изложенных результатов позволяет предложить следующую патогенетическую схему формирования хронических СГ, объединяющую полученные результаты и имеющиеся данные об их патогенезе.
Наиболее важным фактором риска возникновения хронических СГ является церебральная атрофия любого генеза, приводящая к натяжению проходящих в увеличенном субдуральном пространстве мозговых вен и их повышенной повреждаемости при минимальном травматическом воздействии. Излившийся вследствие повышения внутричерепной резервной емкости большой объем крови не приводит, как при обычном течении СГ, к сдавлению ГМ, а без выраженных клинических проявлений подвергается организации с формированием капсулы большой (более 0,7 мм) толщины, представленной фиброзной тканью со значительным количеством синусоидных капилляров и интенсивной воспалительной инфильтрацией. В дальнейшем из-за повторных, обусловленных особенностями местной гемоциркуляции, кровоизлияний в толщу капсулы происходят увеличение и клиническая манифестация хронической СГ. Поскольку наиболее частой причиной церебральной атрофии является возрастная инволюция мозга, то типичным для образования хронических СГ является пожилой и старческий возраст [602], хотя данный факт не исключает возможность развития хронической СГ и в более молодом возрасте [600,606].
Риск возникновения повторных интракапсулярных кровоизлияний и образования хронической СГ наиболее велик в первые 3 месяца существования гематомы, когда формирующаяся на границе с ТМО грануляционная ткань еще не подверглась созреванию, богата синусоидными капиллярами и воспалительной клеточной инфильтрацией. Спустя 3 месяца заместившие СГ фиброзные напластовывания подвергаются постепенной трансформации в оформленную плотную волокнистую соединительную ткань с небольшим количеством сосудов, хорошо развитым волокнистым компонентом и минимумом воспалительной инфильтрации, что значительно снижает количество и объем повторных микрогеморрагий и соответственно риск возникновения хронической СГ. Изложенное позволяет выделить в стадии резорбции любой СГ интервалы нестабильной и стабильной организации, разделенные точкой давности, равной 3-м месяцам.
С патофизиологических позиций возникновение повторных кровоизлияний в капсулу хронической СГ объясняется развитием патологии гемостаза как на уровне содержимого гематомы, так и в организме в целом. В частности, содержимое хронических СГ характеризуется выраженным в различной степени уменьшением концентрации плазменных факторов свертывания и одновременным увеличением уровня антикоагулянтов и продуктов деградации фибриногена [610,611]. В эндотелии макрокапилляров капсулы хронических СГ обнаружена выраженная иммуноэкспрессия антикоагулянта тромбомодулина [612]. В плазме крови и содержимом хронических СГ регистрируются разнообразные тромбоцитарные дисфункции [613-616]. Также установлено, что ЧМТ с наличием ОПГМ сопровождается развитием острой коагулопатии [617].
В целом спектр формирующихся локальных и системных дефектов гемостаза препятствует свертыванию жидкого содержимого хронической СГ и способствует развитию повторных кровоизлияний в ее капсулу и полость [611]. Имеющиеся данные о корреляции концентрации факторов свертывания в содержимом хронической СГ и его КТ-плотностью позволяют в настоящее время по результатам нейровизуализации хронической СГ прогнозировать риск повторных кровоизлияний из макрокапилляров капсулы гематомы [610].
Наряду с повторными интракапсулярными кровоизлияниями в качестве значимого механизма увеличения объема хронических СГ рассматривается также экссудация плазмы через синусоидные капилляры наружной капсулы [618-621]. Факт проникновения белков плазмы в содержимое хронических СГ был доказан путем регистрации кинетики меченного различным образом сывороточного альбумина [618,620]. Подобным путем было выяснено, что скорость экссудации протеинов плазмы в содержимое гематомы неодинакова и положительно коррелирует с тяжестью состояния и возрастом пострадавших [618-620]. Гетерогенность экссудативных процессов позволила даже авторам соответствующих исследований классифицировать хронические СГ в зависимости от концентрации плазменных протеинов в их жидкофазном содержимом на гематомы низкой, средней и высокой плотности [618-621].
В целях раскрытия тонких механизмов транскапиллярной экссудации и самопроизвольного увеличения объема хронических СГ предпринимались попытки измерения концентрации различных воспалительных и противовоспалительных цитокинов, факторов свертывания и естественных антикоагулянтов в плазме крови, содержимом хронических СГ, их капсулах и ТМО [622-625], фактора роста эндотелия сосудов и аквапорина 1 в капсуле гематомы и эндотелии ее макрокапилляров [626-629].
Благодаря проведенным исследованиям установлено, что высокая проницаемость синусоидных капилляров для форменных элементов и плазменных протеинов объясняется особенностями строения указанных сосудов. Являясь обязательным и типичным структурным компонентом капсул хронических СГ, синусоидные капилляры отличаются большим диаметром (более 40 мкм). Стенка синусоидных капилляров состоит из одного слоя уплощенных эндотелиальных клеток и неполного слоя из немногочисленных перицитов и гладкомышечных клеток [611]. Эндотелиальный слой макрокапилляров не является непрерывным и отличается наличием промежутков диаметром до 2 мкм между эндотелиальными клетками [611]. Базальная мембрана синусоидных капилляров также фенестрирована. Комплекс перечисленных дефектов в эндотелиальной выстилке, базальной мембране капилляра и перицитарном слое делает возможным выход в экстраваскулярное пространство не только плазмы крови, но и ее форменных элементов [611]. Названный механизм поддерживает персистенцию хронической СГ и способствует самопроизвольному ее увеличению и рецидивированию после хирургической эвакуации гематомы [630,631].
Таким образом, хроническим СГ присущи следующие отличительные особенности:
- основной источник гематомы – повреждения субдуральных сегментов поверхностных мозговых вен;
- преимущественное развитие после минимальной по интенсивности механической травмы головы или при отсутствии таковой;
- развитие на фоне возрастной церебральной атрофии или на фоне кранио-церебральных диспропорций иного генеза;
- отсроченное развитие симптомов церебральной компрессии (спустя 14 и более суток после начала кровотечения в субдуральное пространство);
- способность к персистенции и самопроизвольному увеличению своего объема;
Указанные особенности хронических СГ закономерно определяют основную проблему судебно-медицинской оценки указанных кровоизлияний – необходимость объективного дифференцирования их травматического или нетравматического генеза.

