Вы здесь
4.1. Патофизиология и патоморфология сдавления головного мозга субдуральными гематомами
ГЛАВА 4. Судебно-медицинская оценка биомеханики сдавления головного мозга субдуральными гематомами
Сдавление ГМ представляет собой патологический процесс, характеризующийся нарушением объемных соотношений полости черепа и его содержимого. Причинами церебральной компрессии являются эпидуральные, субдуральные и внутримозговые гематомы, вдавленные переломы черепа, очаги размозжения объемного типа, опухоли и опухолеподобные процессы мозга, его оболочек, черепных нервов и черепа, инфаркты мозга, внутричерепные гигромы, гидроцефалия и пневмоцефалия [38]. Многие из перечисленных форм травматической и нетравматической церебральной компрессии могут сочетаться между собой.
Развитие сдавления ГМ определяется соотношением объемов полости черепа и его содержимого. С момента описания А. Monroe в 1783 г. первой патофизиологической модели церебральной компрессии, взгляды на развитие последней претерпели сильные изменения.
Доктрина А. Monroe рассматривала полость черепа в качестве «закрытого ящика», в котором появление любого патологического объема автоматически приводит к повышению внутричерепного давления [цит. по 460]. В настоящее время установлено, что величина внутричерепного давления определяется взаимоотношениями двух компонентов: церебрального кровообращения и ликвороциркуляции [461]. Сосудистый компонент сложно оценить количественно, поскольку он весьма изменчив и его величина складывается под влиянием множества факторов, основными из которых являются артериальное давление и церебральный венозный отток [461-463]. Ликворный циркуляторный компонент может быть охарактеризован формулой H. Davson, G. Hollingsworth и M.B. Segal, согласно которой значение ликворного компонента в величине внутричерепного давления определяется суммой резистентности к оттоку ликвора через паутинную оболочку и ее дериваты в кровеносную систему ТМО и давления крови в верхнем сагиттальном синусе [464]. Отсюда любой фактор, способствующий увеличению венозного давления в ГМ и/или экстрацеребральных интракраниальных структурах или приводящий к обструкции ликвороносных путей, может спровоцировать рост внутричерепного давления. Увеличение внутричерепного давления может быть вызвано даже простым сдавлением яремных вен, но наиболее значимой причиной повышения внутричерепного давления являются различные интракраниальные объемные образования (гематомы, опухоли и т.д.) [461].
Внутричерепное давление путем своего вычитания из среднего артериального давления определяет величину церебрального перфузионного давления. Последнее представляет собой градиент давления, необходимый для осуществления церебрального кровоснабжения [465]. Ауторегуляторный запас церебрального перфузионного давления рассматривается как разность между средней величиной указанного давления и его нижним допустимым пределом, который равен 60-70 мм рт. ст. [461]. Любые колебания церебрального перфузионного давления при повышенном внутричерепном давлении могут сопровождаться развитием определенных патологических реакций. В частности, снижение церебрального перфузионного давления вызывает ишемию мозга с развитием соответствующих альтеративных изменений. Повышение церебрального перфузионного давления приводит к гиперемии и развитию вазогенного отека ГМ с последующим вторичным повышением внутричерепного давления [466,467].
Ряд экспериментальных исследований, проведенных на различных видах животных (собаки, свиньи, приматы), доказал наличие у млекопитающих определенного резерва резистентности к повышению внутричерепного давления [460,468,469]. Нормализация внутричерепного давления может быть достигнута благодаря ряду компенсаторно-приспособительных процессов, совокупность которых образуют следующие защитные механизмы: 1) уменьшение объема ликвора за счет вытеснения его из желудочков и цистерн; 2) уменьшение внутричерепного объема венозной крови; 3) локальная атрофия мозговой ткани вокруг ограниченного патологического образования или диффузная атрофия при внутренней гидроцефалии; 4) спонтанный прорыв стенок желудочков; 5) расхождение черепных швов [38].
Из перечисленных механизмов компенсации внутричерепного давления наиболее лабилен объем ликвора, который может быть вытеснен в спинальное субарахноидальное пространство. Однако этот фактор компенсации срабатывает только при сохранности путей оттока и при исходном достаточном количестве ликвора. Эффект от уменьшения объема внутричерепной крови крайне незначителен. Церебральная атрофия и расхождение черепных швов развиваются только в условиях медленного увеличения добавочного патологического внутричерепного объема, причем расхождение швов возможно только у детей. Недостаточность существующих компенсаторных механизмов приводит к развитию отека, деформаций и дислокаций ГМ.
Отек (гипергидратация) ГМ представляет собой увеличение содержания в нем воды. С патофизиологических позиций отек ГМ подразделяют на 5 видов: вазогенный, цитотоксический, гидростатический, гипоосмотический и интерстициальный [31,38].
Вазогенный отек возникает вследствие нарушения проницаемости сосудистой стенки и усиленной фильтрации плазмы с повышением содержания внеклеточной жидкости и преимущественным ее скоплением в белом веществе.
Цитотоксический отек развивается при экзогенной или эндогенной интоксикации клеток мозга. При этом происходит накопление внутриклеточной жидкости с поражением всех клеточных элементов, наиболее чувствительными из которых являются астроциты [31].
Гидростатический отек образуется вследствие внезапного повышения внутрисосудистого давления и характеризуется увеличением объема крови, циркулирующей в церебральной кровеносной системе. От вазогенного отека гидростатический отек отличается сохранностью гематоэнцефалического барьера.
Гипоосмотический отек возникает вследствие нарушения существующего небольшого осмотического градиента между осмолярностью ткани мозга и плазмы. Поэтому данный отек развивается при повышении осмолярности ткани мозга, при понижении осмолярности плазмы либо при сочетании обоих указанных механизмов.
Интерстициальный (перивентрикулярный) отек наблюдается в результате повышения давления ликвора в желудочках мозга. При этом происходит прямой выход жидкости из вентрикулярной системы в прилегающее белое вещество мозга.
В зависимости от степени распространенности отек мозга может быть ограниченным или диффузным. Локальный отек мозга иногда разрешается с развитием в последующем атрофии в его области.
Патоморфологическая диагностика отека ГМ в основном осуществляется, опираясь на показатели консистенции, объема и массы ГМ, а также вида его поверхности на разрезах. При наиболее частом вазогенном типе отека ГМ вследствие увеличения содержания в нем внеклеточной жидкости приобретает рыхлую консистенцию, иногда достигающую степени флюктуации [38,470]. Ткань его избыточно влажная, с большим количеством выступающей из сосудов крови, быстро растекающейся на поверхностях разрезов. Однако указанные характеристики имеют относительное значение. Так, при цитотоксическом отеке ГМ характеризуют как плотный, эластичный, с сухими поверхностями разрезов [38]. При гипоосмотическом отеке вытекающая в небольшом количестве внутрисосудистая кровь на поверхностях разрезов не растекается. Кроме того, перечисленные визуальные и пальпаторные характеристики головного мозга являются субъективными.
В отличие от визуально-пальпаторных характеристик объемно-весовые показатели ГМ представляют собой объективные диагностические критерии. Правомочность их применения основывается на существовании параллелизма между повышением степени гидратации ГМ и увеличением его объема и массы. Вместе с тем объем и масса ГМ связаны со степенью его гидратации зависимостью стохастического типа. Это означает, что помимо степени гидратации, на величину объема или массы мозга также влияет большое количество других факторов, наибольшее значение из которых имеют такие индивидуальные особенности, как возраст и пол умершего, наличие у него какой-либо врожденной или приобретенной патологии [471].
Таким образом, все перечисленные рутинные диагностические критерии являются непрямыми показателями отека ГМ и отражают только какие-либо его отдельные проявления, будучи с ними стохастически взаимосвязанными. В этой связи вполне справедливым следует считать мнение многих исследователей, полагающих, что такое фундаментальное понятие танатологии, как отек ГМ, при аутопсиях по-прежнему оценивается во многом субъективно [472].
Прямым показателем наличия или отсутствия отека ГМ является степень его гидратации. В настоящее время разработан ряд базовых и модифицированных методик определения относительного содержания воды в тканях ГМ [472,473]. Сущность указанных методик сводится к определению процентного отношения абсолютного содержания воды во фрагменте мозга, вычисляемого по разнице между массами его влажного и сухого вещества, к массе его влажного вещества.
Основанные на указанной методике многочисленные исследования выявили феномен неравномерного, мозаичного распределения воды в различных структурах ГМ и уточнили параметры распределений в них относительного содержания жидкости [472-474]. Кроме того, они показали возможность использования полученных данных не только для установления гипергидратации ГМ, но и в целях дифференциальной диагностики вариантов танатогенеза, причин смерти и определения длительности терминального периода [474-476].
Существует определенная взаимосвязь между распространенностью и степенью гидратации ГМ и уровнем повышения внутричерепного давления. Однако данная взаимосвязь не является функциональной, вследствие чего даже при гипергидратации ГМ внутричерепное давление может быть низким. В связи с этим при экспертной оценке церебральной компрессии особую важность приобретает выяснение наличия или отсутствия церебральных деформаций, вторичных интрацеребральных кровоизлияний и ишемических повреждений мозга. В силу взаимозависимости указанных патологических изменений с отеком мозга их обнаружение позволяет достоверно диагностировать отек ГМ, даже если относительное содержание в нем воды соответствует степени гипогидратации. В таких случаях гипогидратацию следует расценивать как отек мозга на фоне индивидуального низкого содержания воды в церебральных тканях. Ввиду значительных индивидуальных колебаний относительного содержания воды в тканях ГМ при наличии СГ и отсутствии проявлений сдавления и дислокации мозга с осторожностью следует также оценивать имеющуюся церебральную гипергидратацию как значимый танатогенетический фактор.
Другими значимыми патологическими реакциями ГМ на повышение внутричерепного давления являются церебральные деформации и дислокации, которые в зависимости от локализации причины компрессии представляют собой попытки перемещения частей мозга внутри супратенториального или субтенториального пространств, за их пределы, а также из полости черепа вообще [31,38].
При всех видах смещения ГМ макроскопически определяются уплощение его извилин и сужение борозд, расширение вен коры. Другие особенности макроскопической картины сдавления мозга определяются конкретным видом его смещения.
Различают следующие типы смещения мозга: латеральное, нисходящее и восходящее транстенториальные (одно – и двусторонние), трансалярные, смещение мозжечка в затылочно-шейную дуральную воронку, смещение мозга в дефект черепа [31,38].
Латеральная дислокация представляет собой смещение одной поясной извилины, расположенной на стороне очага компрессии, через срединную линию под свободный край серпа большого мозга. При данном типе смещения обычно наблюдаются сужение желудочка на стороне повреждения и увеличение контралатерального желудочка, обусловленное компрессией отверстий Монро. Больше смещаются передние отделы поясных извилин, на которых образуются полосы вдавления от края серпа большого мозга.
Нисходящая транстенториальная дислокация характеризуется смещением частей ГМ под намет мозжечка. Выделяют центральный и латеральный, а также одно – и двусторонний подтипы нисходящего транстенториального смещения. При центральной нисходящей транстенториальной дислокации происходит преимущественное каудальное перемещение нижних отделов среднего мозга, при латеральной нисходящей транстенториальной дислокации – медиальное и каудальное перемещение крючка и парагиппокампальной извилины с одной (односторонняя дислокация) или двух (двусторонняя дислокация) сторон.
Односторонняя нисходящая транстенториальная дислокация возникает в качестве проявления односторонней супратенториальной компрессии мозга. Аналогичная двусторонняя дислокация характерна для двусторонней супратенториальной компрессии.
При нисходящем транстенториальном смещении вырезка намета заполняется медиальными отделами височных долей и нижними отделами среднего мозга. Последний сдавливается и уменьшается в поперечнике. При тяжелых нисходящих смещениях передняя хориоидальная, задняя соединительная и задняя мозговая артерии также смещаются в каудальном и медиальном направлениях. В результате вклинения обоих медиальных отделов височных долей наступает полная облитерация базальных цистерн.
Восходящая транстенториальная дислокация часто сочетается с субтенториальным травматическим повреждением и представляет собой направленное вверх вклинение червя и полушарий мозжечка через вырезку намета. Макроскопически при данном типе дислокации верхняя мозжечковая цистерна и четвертый желудочек сужены, зрительные бугры и эпифиз сдавлены. Наряду с мозжечком в отверстие мозжечкового намета может также смещаться и мост мозга. Это проявляется его уплощением в вентрально-дорсальном направлении. Вентральная поверхность моста уплощается, поперечная борозда между ним и продолговатым мозгом сглаживается. При тяжелой субтенториальной компрессии на вентральной поверхности моста может обнаруживаться полоса сдавления от базилярной артерии.
Трансалярные дислокации могут быть восходящими при локализации источника компрессии в средней черепной ямке или нисходящими, если источник компрессии расположен в передней черепной ямке. При восходящей трансалярной дислокации происходит смещение средней мозговой артерии и височной доли, а при нисходящей – лобной доли через большое крыло клиновидной кости. Чаще всего трансалярные дислокации являются односторонними. Однако при двусторонней компрессии мозга могут иметь место и двусторонние трансалярные дислокации. Макроскопически трансалярные смещения проявляются наличием полос сдавления от крыльев клиновидной кости на соответствующих долях мозга.
Дислокация мозжечка в затылочно-шейную дуральную воронку проявляется смещением данной части мозга в большое затылочное отверстие с последующей его облитерацией, окклюзией четвертого желудочка и развитием гидроцефалии. Обычно смещаются язычок червя, миндалины и двубрюшные доли мозжечка. Макроскопически нижняя поверхность мозжечка прижата к затылочной кости, повторяя ее рельеф. На ней определяются дугообразные полосы сдавления от края большого затылочного отверстия. Верхняя поверхность мозжечка уплощена.
Смещения мозга в дефекты черепа возникают вследствие сдавления мозга при наличии открытых переломов черепа или послеоперационных дефектов. Выпяченный участок принимает форму гриба и может иметь кровоизлияния.
Вследствие наличия специфических макроскопических проявлений церебральной компрессии ее диагностика при исследовании трупа обычно не вызывает затруднений. Тем не менее, в целях объективизации диагностического процесса были предложены способы количественного оценивания степени выраженности компрессии мозга, включающие определение индексов его набухания и сдавления [477,478].
Ввиду ограниченности объема полости черепа и сложности ее рельефа дислокации мозга приводят к его вклинениям, под которыми подразумевается вторичная компрессия паренхимы, нервов и сосудов ГМ прилегающими к нему костями черепа и дуральными выступами. Вклинения мозга ведут к усилению тяжести состояния больного и являются более серьезными и угрожающими его жизни, чем первичная травматическая или нетравматическая патология, вызвавшая сдавление мозга. Степень вклинения зависит от множества факторов, включающего локализацию источника компрессии и скорость ее нарастания, наличие исходной церебральной атрофии и др. При вклинениях в соответствующих отделах мозга развиваются тяжелые гемоциркуляторные нарушения, морфологически проявляющиеся вторичными интрацеребральными кровоизлияниями и инфарктами.
Таким образом, к основным патологическим изменениям при церебральной компрессии относятся отек, дислокации и вклинения мозга, нарушения мозгового кровообращения. Указанные процессы тесно взаимосвязаны и способны отягощать друг друга.
СГ являются наиболее частой причиной компрессии мозга и самой частой клинической формой травматического сдавления мозга. Представляя собой депонированную кровь, разобщенную от путей крово – и ликворотока, они приводят к компрессии ГМ и к его дислокации. СГ также приводят к вторичному увеличению объема ГМ за счет нарушения оттока венозной крови и блокады ликворных путей на уровне тенториального кольца, а также вследствие развития компрессионного постишемического локального церебрального отека и рефлекторной артериальной гипертензии [31,38].
Основным патофизиологическим типом отека ГМ, развивающимся при СГ, является вазогенный отек, который обычно становится максимальным в течение первых суток после декомпенсации церебральной компрессии. Однако сдавление мозга СГ может сопровождаться развитием и других типов церебрального отека. Так, цитотоксический отек при СГ обычно возникает вторично вследствие ишемического повреждения мозга. Гидростатический отек наблюдается вследствие внезапного изменения церебрального перфузионного давления после декомпрессионной краниотомии. Гипоосмотический отек при СГ обычно имеет ятрогенный характер, в частности, при искусственном уменьшении осмолярности плазмы за счет внутривенной инфузии низкоосмолярных растворов. Более редкий механизм развития гипоосмотического отека наблюдается при ассоциации травматических СГ с повреждениями гипофизарно-гипоталамической системы. В этих случаях причиной снижения осмолярности плазмы является нарушение секреции антидиуретического гормона [38].
Иногда в генезе церебрального отека при травматических СГ основную роль играет не секвестрированный в субдуральном пространстве объем крови, а иные, ассоциированные с гематомой, внутричерепные повреждения. Например,Y. Seto и S. Takeichi описали редкое наблюдение ассоциации травматической СГ с травматическим тромбозом синусов ТМО у 38-летнего мужчины после его падения с высоты 4,6 м. [99]. В стационаре у этого пострадавшего были диагностированы перелом теменных костей и двусторонняя конвекситальная СГ, локализованная на поверхностях теменных долей, которая была своевременно эвакуирована. Через 5 ч после операции у пострадавшего развились некупируемые отек и дислокация ГМ, спустя 6 суток приведшие к летальному исходу. На аутопсии был обнаружен линейный излом теменных костей, пересекавший сагиттальный шов с повреждением ТМО, которое распространялось на оба поперечных синуса с их обтурирующим тромбозом и резким церебральным отеком. S. Kumar с соавт. описали похожее наблюдение летального тромбоза кавернозного синуса при нетравматической хронической СГ [479].
В зависимости от объема и толщины гематомы, ассоциации с иными внутричерепными повреждениями и ряда других факторов отек ГМ при церебральной компрессии, вызванной СГ, может отсутствовать, иметь локальный или диффузный характер [480]. Полностью все аспекты развития церебрального отека при СГ пока не выяснены. Однако не вызывает сомнений тот факт, что развившись, церебральный отек запускает цепь патофизиологических реакций, определяющих неблагоприятный исход сдавления ГМ. В частности, при наличии церебрального отека смертность у пациентов с острыми СГ превышает 75% даже при условии раннего удаления гематом [480].
При сдавлении мозга СГ в зависимости от их локализации, наличия проникающих повреждений черепа или трепанационных дефектов возможны любые виды церебральных дислокаций. Поскольку по частоте преобладает односторонняя супратенториальная локализация СГ (см. табл. 6), то наиболее распространенными видами смещения мозга при данных гематомах являются латеральная и нисходящая транстенториальная дислокации. Все возможные при СГ типы дислокаций характеризуются указанными выше соответствующими морфологическими изменениями, которые могут быть зарегистрированы как при аутопсии, так и путем прижизненной нейровизуализации [38,481].
В ходе экспериментальных исследований на животных было доказано, что дополнительным существенным патофизиологическим следствием повышения внутричерепного давления при СГ является апоптоз нервных клеток [482,483]. Заметными нейрональные апоптотические процессы становятся спустя 2 суток после искусственного введения крови в субдуральное пространство [482]. При этом незрелый мозг молодых животных менее устойчив к нейрональным апоптотическим процессам, инициируемым моделируемыми СГ [483].
Экспериментально также была показана зависимость резерва церебральной резистентности к повышению внутричерепного давления у млекопитающих от объема СГ [469]. Причем в первые 12 ч существования субдурального источника сдавления мозга динамика развивающихся острых патофизиологических реакций зависела лишь от объема источника церебральной компрессии, а не от его химического состава [469].
Таким образом, непосредственной причиной смерти при естественном течении декомпенсированных травматических СГ должна быть дислокация ГМ. Однако в современных условиях пострадавшим с травматическими СГ, как правило, оказывается специализированная медицинская помощь, включающая краниотомию с эвакуацией гематомы. Указанное медицинское вмешательство и консервативная терапия у части пострадавших предотвращают развитие дислокации ГМ, а у остальных – уменьшают выраженность церебральной компрессии и пролонгируют ее. Это приводит к формированию иных патологических процессов, развитие которых затруднительно или невозможно при естественном течении травматических СГ. К числу указанных процессов относятся воспалительные поражения дыхательной системы, ГМ и мозговых оболочек, развитие инфарктов мозга.
Анализ 467 собственных наблюдений летальной НЧМТ с наличием СГ показал, что дислокация ГМ явилась непосредственной причиной смерти 79,7% (372) пострадавших. При этом у 55,7% (260) пострадавших дислокация ГМ была вызвана первичными травматическими СГ, а у 24,0% (112) пострадавших - рецидивами гематом после их хирургического удаления. В 8,6% (40) НЧМТ с наличием СГ непосредственной причиной смерти явились пневмонии, а в 5,6% (26) – воспалительная патология ГМ и его оболочек. У 6,2% (29) пострадавших дислокация мозга осложнилась развитием его инфарктов различной локализации.
Важно отметить, что дислокация ГМ явилась непосредственной причиной смерти всех пострадавших с отсутствием медицинских вмешательств. Иные непосредственные причины смерти имели место только в случаях оказания медицинской помощи, а воспалительная патология ГМ и его оболочек – только после проведения краниотомий. Частота и сроки реализации непосредственных причин смерти при НЧМТ с наличием СГ приведены на гистограмме на рис. 82.
Также необходимо подчеркнуть, что, несмотря на свой неблагоприятный потенциал, церебральные дислокации, включая такие их формы, как смещение мозжечка в затылочно-шейную дуральную воронку, все же не являются абсолютно смертельным осложнением травмы и допускают возможность благоприятного исхода [484].
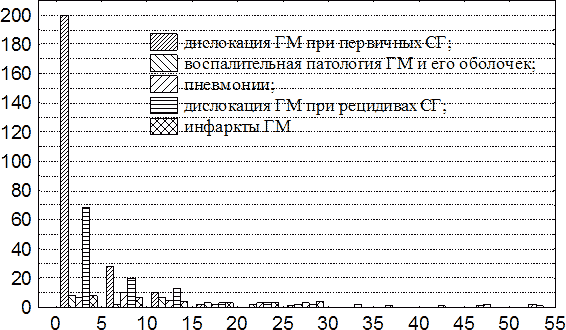
Рис. 82. Гистограмма сроков непосредственных причин смерти при НЧМТ с наличием СГ. По оси абсцисс – давность клинической манифестации сдавления ГМ, сутки; по оси ординат – количество наблюдений.
Церебральной компрессии при СГ присуща определенная фазность клинического развития. Под фазностью понимается закономерная динамика состояния пострадавшего, определяемая взаимосвязью биомеханики церебрального сдавления и компенсаторно-приспособительных возможностей ГМ и организма в целом. В этой связи важнейшими характеристиками клинического течения сдавления ГМ являются понятия компенсации и декомпенсации.
Клиническая компенсация рассматривается как способность ГМ и организма в целом восстановить собственными силами либо с помощью различных внешних факторов и воздействий (в том числе лечебных) дефицит тех или иных функций, обусловленный наличием церебрального сдавления [31,37]. Клиническая декомпенсация рассматривается как частичная или полная утрата этой способности вследствие истощения компенсаторных механизмов под влиянием сдавления ГМ [37]. В настоящее время в клиническом течении сдавления ГМ выделяют 5 фаз: компенсации, субкомпенсации, умеренной декомпенсации, грубой декомпенсации и терминальную фазу [31,37]. Каждая клиническая фаза включает совокупность клинических, инструментальных и лабораторных проявлений сдавления ГМ, определяющих степень нарушения компенсаторных реакций организма.
Фаза клинической компенсации характеризуется хорошим общим состоянием и ясностью сознания пострадавшего. Общемозговая и очаговая симптоматика отсутствует. Наличие СГ может быть установлено только с помощью инструментальных методов, визуализирующих анатомо-топографические изменения в полости черепа.
Фаза клинической субкомпенсации характеризуется удовлетворительным общим состоянием пострадавшего. Сознание ясное, или имеются элементы оглушения. Имеются общемозговые и обычно выявляются различные очаговые неврологические симптомы, чаще мягко выраженные. Симптомы стволовой дислокации отсутствуют. Жизненно важные функции организма не нарушены.
Фаза умеренной клинической декомпенсации проявляется ухудшением общего состояния пострадавшего до средней степени тяжести или тяжелого. Нарушение сознания на уровне оглушения. Нарастают или появляются новые очаговые симптомы. Впервые улавливаются отдельные признаки транстенториальной дислокации. Проявляется тенденция к нарушению жизненно важных функций.
Фаза грубой клинической декомпенсации определяется тяжелым или крайне тяжелым общим состоянием с нарушением сознания до уровня сопора или комы. Нарушения жизненно важных функций приобретают угрожающий характер. В терминальную фазу развивается необратимая кома с грубейшими нарушениями жизненных функций.
Наличие любой из перечисленных фаз в клинической динамике сдавления ГМ необязательно. Смена фаз может осуществляться как в прямом, так и в обратном направлении. При этом переход фаз может быть либо постепенным, либо скачкообразным [31,37].

