Вы здесь
2.2. Источники и генез субдуральных гематом
Данные нормальной и патологической анатомии свидетельствуют о неоднородности возможных источников и непосредственных механизмов формирования травматических и самопроизвольных СГ.
Потенциальными источниками СГ при ЧМТ могут быть следующие нормальные анатомические структуры:
- кости черепа;
- транскраниальные сегменты внутренних сонных и позвоночных артерий, внутренних яремных вен, а также сосуды транскраниальных анатомических структур (черепно-мозговых нервов),
- ТМО, ее отростки и синусы;
- субдуральные сегменты мозговых вен;
- лептоменингеальные артерии и вены;
- церебральные сосуды.
Проникающая ЧМТ в силу своего характера отличается множественностью источников формирования СГ. Так, участие в образовании СГ при проникающей ЧМТ в той или иной мере всегда принимают кости черепа в области его переломов и поврежденные краями перелома сосуды ТМО. Обязательность повреждения экстрадуральных анатомических структур при проникающей ЧМТ в случаях отсутствия сращений ТМО с внутренней поверхностью черепа может приводить к ассоциации СГ с эпидуральными кровоизлияниями [41]. Изредка повреждения сосудов ТМО ввиду непрочности соединения ее эндостального и менингеального листков сопровождаются их расслоением и формированием интрадуральной гематомы [96].
При НЧМТ образование СГ в основном происходит в результате разрывов или отрывов субдуральных отрезков мозговых вен, не имеющих наружных стабилизирующих конструкций, а также вследствие разрывов лептоменингеальных и корковых сосудов в очагах УГМ [97,98]. Однако при данной форме ЧМТ могут наблюдаться и другие источники субдурального кровотечения: повреждения ТМО и ее синусов [99], изолированные повреждения артерий поверхности ГМ или их внеоболочечных сегментов [100], изолированные микроповреждения кортикальных артерий без церебральных контузий [101].
Результаты собственных исследований согласуются с литературными данными, согласно которым среди возможных источников СГ при НЧМТ доминируют повреждения субдуральных сегментов мозговых вен и ОПГМ (табл. 5).
При наличии патологических изменений повреждения внутричерепных анатомических структур могут возникать и приводить к формированию как острых, так и хронических СГ в любых возрастных группах в результате минимальной по интенсивности травмы головы или даже без таковой [102-105]. Один из механизмов образования самопроизвольных СГ связан с развитием васкулитов в ГМ и мозговых оболочках при различных воспалительных процессах.
Таблица 5 Частота различных источников СГ при НЧМТ
| Источник СГ | n | πL | \[\hat p\] | πU |
| Повреждения субдуральных сегментов мозговых вен | 318 | 0,449 | 0,488 | 0,528 |
| ОПГМ с повреждениями мозговых вен или без них |
317 | 0,448 | 0,487 | 0,526 |
| Изолированные повреждения лептоменингеальных сосудов | 11 | 0,008 | 0,017 | 0,030 |
| Повреждения ТМО, дуральных отростков и синусов | 4 | 0,002 | 0,006 | 0,016 |
| Капсула СГ | 1 | 3,889⋅10-5 | 0,002 | 0,009 |
Воспалительные изменения, осложняющиеся образованием СГ, могут иметь характер не только локальных поражений мозговых оболочек и ГМ [106,107], но и быть проявлениями системных воспалительных процессов любой этиологии [108-111], в том числе и неинфекционной [112].
Однако наибольшую роль в образовании самопроизвольных СГ играют различного рода патологические состояния, приводящие к несоответствию объемов полости черепа и нелабильных внутричерепных структур и, как следствие, к натяжению проходящих в увеличенном субдуральном пространстве мозговых вен и их повышенной повреждаемости при минимальном травматическом воздействии. В детском возрасте основную патологию такого рода представляют разнообразные кранио-церебральные диспропорции [113-116], в т.ч. возникающие и при водно-электролитном дисбалансе, например, гипернатриемии [117]. У взрослых механизм развития диспропорций преимущественно связан с церебральной атрофией любой этиологии [103,118-120]. Другим основным фактором риска нетравматических СГ является самопроизвольная внутричерепная гипотензия [121,122], которая наблюдается при истечении ликвора через различные анатомические образования [123]. СГ, возникающие при самопроизвольной внутричерепной гипотензии, отличаются частыми рецидивами и билатеральной локализацией [124-127].
Нередко самопроизвольные СГ возникают при различных генетических нарушениях, преимущественно имеющих характер наследственных нейрометаболических заболеваний и дисплазий костной и соединительной тканей. Из наследственных нейрометаболических заболеваний, осложняющихся развитием СГ, в литературе наиболее часто упоминаются глутаровая ацидурия [128-130], болезнь Хантингтона [131] и мукополисахаридоз [132], из группы костных и соединительнотканных дисплазий – системный остеопетроз [133], несовершенный остеогенез [134,135] и синдром Марфана [136].
Механизм развития СГ при перечисленной генетической патологии преимущественно непрямой и связан с формированием кранио-церебральных диспропорций, реализуемых путем церебральной атрофии и/или нарушений процессов ремоделирования костной ткани и, в частности, костей черепа. Также при некоторых заболеваниях, например, при синдроме Марфана, может иметь место и прямое уменьшения толерантности сосудистой стенки к воздействию механического фактора [136]. В ряде случаев механизм развития самопроизвольных СГ имеет комбинированный характер или его сложно определить [137].
Наряду с комплексом патологических состояний, прямо или опосредованно снижающих толерантность внутричерепных сосудистых структур к механической травме, серьезный фактор риска самопроизвольных СГ представляет широкий спектр заболеваний и синдромов, отличающихся повышенной кровоточивостью, но не имеющих характера вазопатий. Общепринятым является классификационное деление указанных геморрагических диатезов на тромбоцитопении, тромбоцитопатии и коагулопатии.
Коагулопатии представляют собой наиболее распространенный вид геморрагических диатезов, значительно увеличивающий риск СГ без непосредственного ослабления механической толерантности внутричерепных структур – потенциальных источников указанных кровоизлияний. Коагулопатии включают в себя широкий спектр наследственных и приобретенных заболеваний и синдромов, выражающихся различными дефектами в системах гемостаза и/или фибринолиза. Из дефектов системы гемостаза наиболее часто образованием самопроизвольных СГ сопровождаются преимущественно наследственные дефициты факторов VII [138,139], VIII [140-142], X [143], XII [144] и XIII [145]. Среди дефектов системы фибринолиза серьезный риск в отношении самопроизвольных СГ представляют дефицит ингибитора активации плазминогена [146]. Субдуральные кровоизлияния при перечисленных дефектах систем гемостаза и фибринолиза в зависимости от сроков клинической манифестации могут быть как острыми, так и хроническими, а также отличаются выраженной склонностью к рецидивам [140,146,147].
В группе геморрагических диатезов, обусловленных дефектами тромбоцитарного звена гемостаза, доказанной способностью к образованию самопроизвольных СГ обладает идиопатическая тромбоцитопеническая пурпура [148]. Зарегистрирован также случай самопроизвольного развития острой СГ при HELLP-синдроме [149].
Значительная часть геморрагических диатезов, клиническое течение которых закономерно осложняется развитием самопроизвольных СГ, представляет собой состояния, обусловленные сочетанием нарушений различных компонентов системы гемостаза. Наиболее известным представителем последней группы геморрагических диатезов является синдром диссеминированного внутрисосудистого свертывания [150]. Необходимо также отметить появление в литературе большого количества сообщений о развитии СГ на фоне применения антикоагулянтов [119,139,151] и тромболитической терапии [152].
Нередко повреждения существующих в норме внутричерепных структур являются источниками острых и хронических СГ, возникая в условиях отсутствия травмы головы и какой-либо выраженной локальной или системной патологии [120,153,154]. Иногда подобные внутричерепные гематомы сочетаются с аналогичными спинальными кровоизлияниями [155].
Анализ сообщений о развитии самопроизвольных СГ при отсутствии заметных патологических изменений, которые могли бы способствовать образованию указанных кровоизлияний, показывает, что источниками таких СГ являются артерии поверхности ГМ, преимущественно локализованные в области его латеральной (сильвиевой) борозды [102,154,156-159]. Несмотря на то, что источники самопроизвольных артериальных СГ располагаются в субарахноидальном пространстве, указанные субдуральные кровоизлияния в таких случаях могут возникать изолированно, не будучи ассоциированными с СК [156,158].
В литературе высказывается несколько гипотез происхождения самопроизвольных артериальных СГ:
- спонтанный разрыв корковых артерий в точках отхождения от них ветвей под прямым углом, которые являются пунктами потенциальной слабости;
- повреждения субдуральных сегментов аномальных артериальных ветвей, связывающих мозг с дуральной оболочкой (т.н. «переходных» артерий);
- разрывы лептоменингеальных артерий в областях ее спаечных сращений с паутинной или дуральной оболочками;
- повреждения коленообразных изгибов лептоменингеальных артерий в местах их выступания через паутинную оболочку и прилегания к ТМО [156,158,160].
Считается, что для образования каждого из перечисленных повреждений достаточно одних лишь энергичных движений головы, которые на практике не расцениваются в качестве ЧМТ [156]. Самопроизвольные разрывы артериальных сосудов, в частности, «переходных» артерий, могут возникнуть в результате подъема артериального давления, связанного, например, с подъемом тяжестей [160]. Также при наличии «переходных» артерий, предрасполагающими к возникновению самопроизвольных артериальных СГ будут являться те же факторы (кранио-церебральные диспропорции, церебральная атрофия, самопроизвольная внутричерепная гипотензия), что и для нетравматических венозных гематом [103,115,122]. Именно по этой причине в литературе в качестве провоцирующих факторов самопроизвольных артериальных СГ наряду с артериальной гипертензией называются алкоголизм, слабоумие и перенесенные ЧМТ [102]. Приведенные гипотезы также объясняют причины отсутствия ассоциации СГ с СК при субарахноидальной локализации источника кровотечения в субдуральное пространство.
Помимо анатомических структур, имеющихся в норме, источниками травматических и самопроизвольных СГ могут быть разнообразные внутричерепные патологические образования. В рассматриваемом аспекте патологическое образование - это объемная структура («плюс-ткань»), являющаяся пороком развития или формирующаяся вследствие какого-либо патологического процесса травматической, опухолевой, дистрофической, воспалительной или регенераторной природы, а также нарушений циркуляции крови, лимфы или ликвора. К патологическим образованиям относятся, в частности, опухоли, врожденные пороки развития, гематомы, абсцессы, гигромы, внутричерепные скопления воздуха, грануляционная ткань, рубцы, аневризмы и варикозные расширения. Вместе с тем, согласно данному определению, к патологическим образованиям нельзя отнести патологические процессы, обладающие свойством «минус-ткани» (аплазии, врожденные дефекты костей черепа и т.п.). В зависимости от своего агрегатного состояния патологические образования могут быть газами (пневмоцефалия), жидкостями (гигрома, гидроцефалия, гематома) или твердыми телами (опухоль, рубец).
Следует отметить, что не каждое патологическое образование может быть повреждено и стать источником кровотечения в субдуральное пространство. Например, к таковым необходимо отнести пневмоцефалию и внутричерепные инородные тела. Однако подавляющее большинство внутричерепных патологических образований представляет собой множество потенциальных источников травматических и самопроизвольных СГ. К числу указанных патологических образований относятся арахноидальные кисты, внутричерепные аневризмы, внутричерепные сосудистые мальформации, многочисленные патологические поражения церебральных сосудов, ГМ и его оболочек дистрофической, воспалительной и опухолевой природы [161,162]. Ниже приведена краткая характеристика наиболее типичных патологических состояний, приводящих к возникновению СГ.
Арахноидальная киста представляет собой заполненное ликвором кистозное образование, расположенное в субарахноидальном пространстве. Арахноидальные кисты условно разделяют на первичные (истинные) и вторичные. К первичным относят врожденные арахноидальные кисты, образующиеся во время развития мозговых оболочек [163-165], а к вторичным – ликворные кисты, возникающие в исходе ЧМТ, после перенесенного менингита или оперативного вмешательства [37]. В отличие от врожденных ликворных образований стенки вторичных арахноидальных кист формирует арахноидальный рубец, а не выстланные арахноидэндотелием структурные элементы арахноидального пространства.
Основным осложнением арахноидальной кисты является кровоизлияние в ее полость с последующим распространением в субдуральное пространство и образованием СГ [165-168]. Указанные ассоциации интракистозного и субдурального кровоизлияний могут возникать как после интенсивной или незначительной механической травмы [163,164,169], так и самопроизвольно [167,170,171]. Особенно часто арахноидальные кисты приводят к формированию хронических СГ [168,172]. Так, согласно данным К. Wester и С.А. Helland, обобщивших результаты пролонгированного клинического наблюдения за 241 пациентом, хронические СГ осложняют течение арахноидальных кист в 4,6% случаев [173]. В этом же исследовании авторами было показано, что частота возникновения хронических СГ неодинакова при различных локализациях арахноидальных кист, достигая, в частности, 6,5% при височной локализации последних.
Нередко арахноидальные кисты, приведшие к образованию СГ, бывают ассоциированы с иной системной или внутричерепной патологией. В частности, в литературе имеются описания ассоциаций таких арахноидальных кист с наследственными и инфекционными заболеваниями [174,175]. Имеются также данные о возникновении кровоизлияния из бессимптомной арахноидальной кисты в ходе эвакуации травматической СГ [176].
Внутричерепные аневризмы являются полиэтиологическим страданием, поскольку в их генезе принимают участие любые патологические процессы и травмы, приводящие к изменению нормальной сосудистой стенки [177]. В качестве основных нетравматических патологических процессов, изменяющих сосудистую стенку, следует указать врожденные дефекты церебральных артерий (рис. 6), инфекционные и опухолевые поражения, атеросклероз и артериальную гипертонию. Частым осложнением нетравматических интракраниальных аневризм являются СГ, возникающие самопроизвольно или после эпизода механической травмы головы любой интенсивности [178-181].
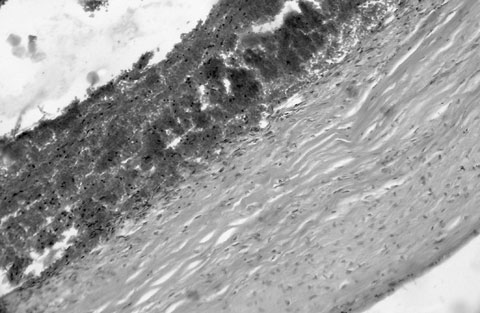
Рис. 6. Врожденная интракраниальная аневризма у 29-летней беременной женщины, осложнившаяся массивным базальным субарахноидальным кровоизлиянием с распространением крови в субдуральное пространство. Гематоксилин и эозин. Увеличение 64х.
СГ, осложняющие внутричерепные аневризмы, обычно ассоциируются с СК [181], однако при определенных условиях могут возникать изолированно [182-186], а также иметь межполушарную или двустороннюю локализацию [161,179,184]. Иногда при развитии СГ наблюдаются сложные ассоциации аневризм с другой внутричерепной патологией. Так, Н. Kocaeli и Е. Korfali сообщили о случае развития хронической СГ вследствие разрыва аневризмы в месте бифуркации средней мозговой артерии, располагавшейся внутри арахноидальной кисты [187].
Сосудистые мальформации – это группа преимущественно врожденных аномалий развития сосудов ГМ, представляющих собой переплетение аномальных сосудов с прямым шунтированием между артериями и венами [188,189]. Распространенным обозначением указанных сосудистых аномалий является также термин «артерио-венозные мальформации», который можно расценивать как синоним. Выделяют четыре типа сосудистых мальформаций: капиллярные телеангиэктазии, кавернозные гемангиомы, венозные ангиомы и артериовенозные мальформации [188,190]. Существуют также и другие схемы, классифицирующие сосудистые мальформации по их этиологии, локализации, распространенности, размеру и морфологическому типу [191]. В частности, предлагается различать ангиоматозные пороки развития, к которым относят кавернозные и рацемозные мальформации, и неангиоматозные пороки, включающие варикоз, артерио-венозные фистулы и персистирующие эмбриональные сосуды.
В узком смысле к сосудистым мальформациям относят ангиоматозные пороки развития, включающие кавернозные и рацемозные мальформации. Кавернозными мальформациями именуют конгломераты сосудистых полостей с отсутствием элементов мозговой ткани между ними. Рацемозные мальформации представляют собой клубки извитых сосудов, между которыми расположена мозговая или иная ткань (рис. 7). Между кавернозными и рацемозными мальформациями существуют также и промежуточные формы.
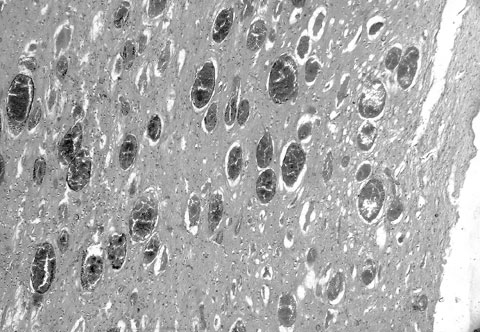
Рис. 7. Множественная рацемозная мальформация большого мозга, осложнившаяся двусторонним субарахноидальным кровоизлиянием и летальной двусторонней субдуральной гематомой после механической травмы головы. Гематоксилин и эозин. 64х.
Сосудистые мальформации являются весьма распространенной патологией. Согласно данным широкомасштабных эпидемиологических исследований частота выявления сосудистых мальформаций составляет 1,21 (95% ДИ: 1,02-1,42) случая на 100000 человек в год [192]. Популяционная частота геморрагических осложнений сосудистых мальформаций составляет 0,42 (95% ДИ: 0,32-0,55) случая на 100000 человек в год [192].
Прогностическое значение различных типов сосудистых мальформаций неодинаково. Меньшую опасность в плане геморрагических осложнений представляют капиллярные телеангиэктазии [192]. Основными типами внутричерепных кровоизлияний, осложняющих клиническое течение сосудистых мальформаций, являются субарахноидальные и внутримозговые кровоизлияния с распространением в субдуральное пространство или без такового. В большинстве случаев СГ при сосудистых мальформациях возникают самопроизвольно, однако указанные кровоизлияния могут ассоциироваться с ЧМТ, в том числе и с ее тяжелыми формами [193].
Из неангиоматозных пороков наиболее частым представителем сосудистых мальформаций, приводящих к развитию посттравматических и нетравматических СГ, являются артерио-венозные фистулы [194-196]. Существует множество схем, классифицирующих артерио-венозные фистулы по их этиологии, локализации, латерализации, распространенности, ангиоархитектонике и клиническому течению [197]. Основными из них являются классификационные схемы С. Cognard и J. Borden, а также их многочисленные модификации, разделяющие интракраниальные артерио-венозные фистулы по особенностям ангиоархитектоники, в частности, по характеру артериального притока и венозного оттока [198,199].
На практике доступными для посмертной диагностики являются лишь следующие кластерообразующие свойства интракраниальных артерио-венозных фистул: характер и локализация артерио-венозного шунта, латерализация и распространенность. При этом по характеру артерио-венозного шунта фистулы следует делить на прямые (между крупными артериями и синусами ТМО или венами) и непрямые (между мелкими артериями и синусами ТМО или венами), по латерализации – на односторонние или двусторонние, по распространенности – на единичные, множественные (имеющие несколько зон соустий, не связанных между собой общими источниками кровоснабжения) и распространенные (поражения обширных областей дуральной оболочки и нескольких синусов, имеющие общие источники кровоснабжения), а по локализации артерио-венозного шунта – на дуральные, пиальные и дурально-пиальные [197].
В отличие от посттравматических фистул, наиболее частой формой которых являются каротидно-кавернозные соустья [37], нетравматические артерио-венозные фистулы преимущественно имеют характер дуральных, представляя собой анормальные соединения артерий и вен в составе краниальной дуральной оболочки [197,200]. Точные причины развития дуральных артерио-венозных фистул пока не установлены [200,201]. СГ являются основным типом внутричерепных кровоизлияний, осложняющих клиническое течение дуральных и дурально-пиальных фистул. Пиальные артерио-венозные фистулы обычно приводят к развитию СК с последующим прорывом в субдуральное пространство.
Наряду с известными типами ангиоматозных и неангиоматозных сосудистых мальформаций источниками СГ могут быть и неклассифицируемые или неизвестные ранее пороки сосудов. Например, в 2010 г. группой японских исследователей был впервые описан доказанный морфологическими данными случай самопроизвольной артериальной острой СГ, источником который явилось повреждение анастомоза между ТМО и церебральной артерией [160]. До этого существование «переходных» артерий и их участие в генезе самопроизвольных СГ предполагалось лишь гипотетически [156].
Одним из патологических внутричерепных образований, способных исполнять роль источника СГ, являются разнообразные опухолевые процессы, которые можно классифицировать на первичные доброкачественные и злокачественные опухоли мозговых оболочек и мозга и вторичные опухолевые поражения указанных анатомических образований преимущественно метастатического характера.
Наиболее часто к развитию СГ приводят первичные опухоли ТМО и ГМ доброкачественного или пограничного характера в силу их большой популяционной частоты (рис. 8,9). Основной гистогенетической формой данных опухолей является менингиома [202,203]. Субдуральные кровоизлияния, осложняющие естественное течение менингиом, отличаются разнообразной локализацией, в том числе и билатеральной [204], а по срокам клинической манифестации могут быть как острыми [205,206], так и хроническими [204]. Из других, в том числе и злокачественных гистогенетических форм первичных опухолей к образованию СГ приводят дуральные гемангиоперицитомы [207], дуральные саркомы [208], астроцитомы [209], малигнизированные ганглиоглиомы [210], а также различные лимфоцитарные и гистиоцитарные пролиферативные опухоли, в частности, некоторые формы гистиоцитоза Х [211] и неходжкинские лимфомы [212]. В отношении последних недавно была доказана принципиальная возможность их развития в ТМО и гистогенетическая общность с В-клеточными MALT-лимфомами [213]. Группа иранских исследователей сообщила также о случае ассоциации хронической СГ с субдуральной эмбриональной рабдомиосаркомой, в котором дискутабельной является последовательность развития опухолевого процесса и кровоизлияния в субдуральном пространстве [214].
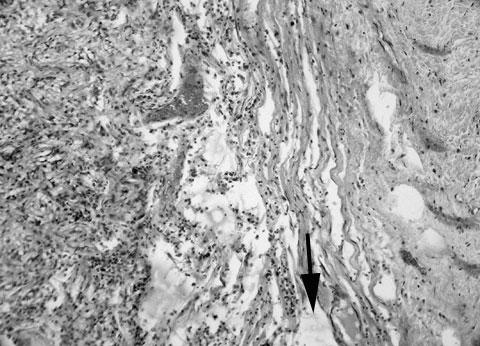
Рис. 8. Гемистоцитическая астроцитома ПБМ с прорастанием лептоменинкса и инфильтрацией ТМО. Стрелкой показано субдуральное пространство. Справа от стрелки – ТМО. Гематоксилин и эозин. Увеличение 64х.
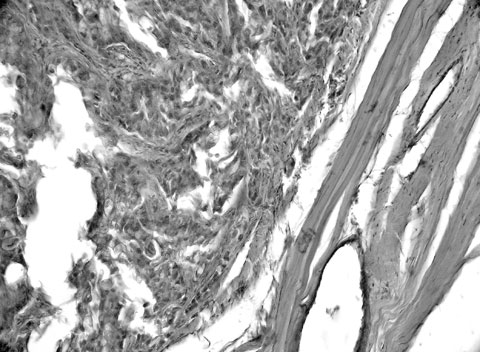
Рис. 9. Дуральный метастаз неороговевающего плоскоклеточного рака кожи.Гематоксилин и эозин. Увеличение 64х.
Вторичные опухолевые поражения ТМО и ГМ, приводящие к развитию СГ, преимущественно имеют характер метастазов злокачественных опухолей экстрадуральной первичной локализации (рис. 10,11). Дуральные метастазы развиваются достаточно часто, на аутопсии их находят у 8-9% пациентов с системным раком [215]. В дуральной оболочке метастазы рака и других злокачественных опухолей обычно возникают в результате непосредственного гематогенного заноса опухолевой ткани в сосуды ТМО [215]. Реже к СГ приводят контактные опухолевые поражения ТМО, развивающиеся путем прорастания в полость черепа разнообразных краниальных метастазов [215,216]. В литературе имеется большое количество сообщений о возникновении преимущественно хронических СГ из дуральных метастазов рака молочной [217-220] и предстательной [221] желез, рака желудка [222,223], легкого [217,224, 225], шейки матки [226] и толстой кишки [217]. В связи с возможностью развития дуральных метастазов в литературе активно обсуждаются проблемы дифференциальной диагностики указанных опухолевых поражений с СГ [227,228].
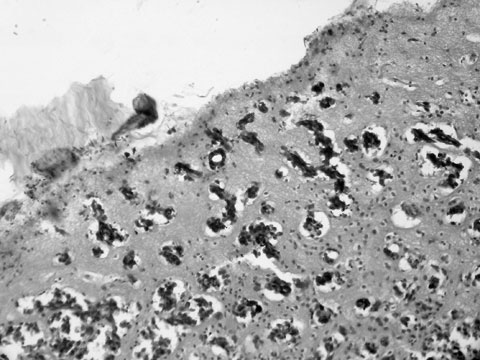
Рис. 10. Церебральный метастаз меланомы кожи с инфильтрацией коры большого мозга и лептоменинкса. Гематоксилин и эозин. Увеличение 129х.
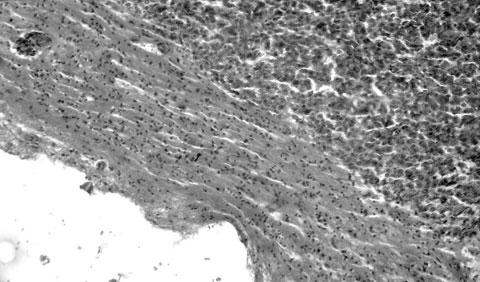
Рис. 11. Субкортикальный церебральный метастаз плоскоклеточного неороговевающего рака легкого со сквозной опухолевой инфильтрацией коры большого мозга, некрозами и вторичными внутриопухолевыми кровоизлияниями с их прорывом в субдуральное пространство и формированием самопроизвольной острой супратенториальной СГ объемом 80 мл. Гематоксилин и эозин. Увеличение 64х.
Кроме банальных эпителиальных карцином источниками СГ являются также дуральные и церебральные метастазы хорионэпителиомы [229-231], лимфомы [217], злокачественной мезотелиомы [232]. Дуральные метастазы могут также иметь характер локальных проявлений системных миелопролиферативных опухолевых процессов [233-235]. В этой связи следует отметить, что в капсулах хронических СГ возможно развитие очагов экстрамедуллярного гемопоэза неопухолевой природы, которые могут быть ошибочно приняты за опухолевый миелопролиферативный процесс дуральной локализации, послуживший источником субдурального кровоизлияния [236]. Неопухолевые поликлональные очаги экстрамедуллярного гемопоэза могут также возникать и в самой дуральной оболочке, симулируя в этом случае наличие СГ [237].
Патологические образования - источники СГ также бывают представлены разнообразными дистрофическими и воспалительными процессами [238]. Некоторые формы воспалительных поражений ТМО, например, идиопатический гипертрофический пахименигит, способны симулировать наличие капсул резорбированных СГ [239].
Ряд внутричерепных патологических образований закономерно возникает в исходе перенесенной ЧМТ и поэтому относится к группе ее многочисленных последствий (осложнений) [37]. Эти образования наряду с тривиальными травматическими повреждениями нормальных внутричерепных анатомических структур являются потенциальными источниками СГ и, несмотря на свое отсутствие в норме, каузально связаны с перенесенной ЧМТ. К наиболее частым и типичным таким патологическим образованиям следует отнести травматические истинные и ложные внутричерепные аневризмы [240-242], посттравматические артерио-венозные фистулы [188] и капсулы СГ [243,244].
Травматические внутричерепные аневризмы чаще развиваются у детей, чем у взрослых. Среди пациентов с церебральными аневризмами доля травматических аневризм менее 1% [177]. Клинически травматические аневризмы обычно манифестируют эпизодом развития внутричерепного кровоизлияния спустя некоторое время после причинения ЧМТ [177]. Клинико-анатомическими формами последнего могут быть субарахноидальные, субдуральные, кортикальные и интравентрикулярные кровоизлияния [240,241]. В среднем промежуток времени от момента ЧМТ до развития внутричерепного кровоизлияния из полости аневризмы составляет 21 день [177].
В зависимости от гистологического строения своей стенки травматические аневризмы классифицируются на истинные, ложные и смешанные (рис. 12,13). Считается, что в механизме развития истинных травматических аневризм лежит разрыв или надрыв одного из слоев стенки кровеносного сосуда, не исключается также возможность перерастяжения сосуда, превышающее предел его эластичности [37]. В отличие от истинных к образованию ложных травматических аневризм приводит сквозное повреждение стенки сосуда. В этом случае полость аневризмы ограничивают не сохранившиеся оболочки сосудистой стенки, а окружающие сосуд анатомические структуры.
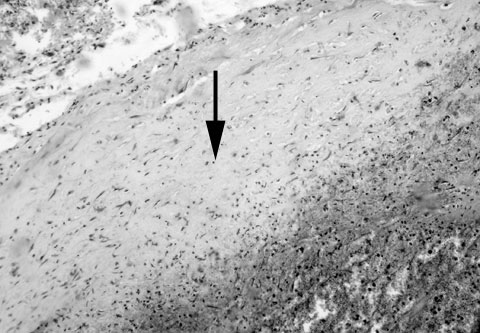
Рис. 12. Истинная травматическая внутричерепная аневризма. Гематоксилин и эозин. Увеличение 64х. Стрелкой показана стенка аневризмы. Слева от стрелки - субарахноидальное пространство, справа – полость аневризмы.
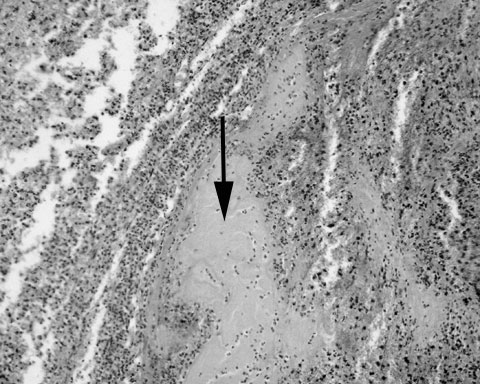
Рис. 13. Ложная травматическая внутричерепная аневризма. Гематоксилин и эозин. Увеличение 64х. Стрелкой показана стенка псевдоаневризмы, представленная свернувшейся кровью. Слева от стрелки - субарахноидальное пространство, справа – содержимое псевдоаневризмы (тромб).
По форме травматические аневризмы классифицируют на мешотчатые и веретенообразные (фузиформные). В веретенообразных аневризмах часто наблюдается расслоение стенки на значительном ее протяжении с формированием расслаивающей аневризмы [37].
Посттравматические артерио-венозные фистулы возникают в результате разрыва артериальной стенки [245]. Характеристическим свойством данной патологии является наличие артерио-венозного шунта. Развитию посттравматических артерио-венозных фистул способствуют анатомические особенности церебральных сосудов (слабое развитие мышечной оболочки), а также наличие дотравматических атеросклеротических и инфекционных васкулярных поражений [37].
Изредка в качестве источника СГ могут выступать и другие посттравматические изменения: арахноидальные кисты, оболочечно-мозговые рубцы, новообразованная грануляционная ткань при посттравматических пахименингитах и арахноидитах, рубцовые изменения в области трепанационных дефектов и внутричерепных инородных тел. Например, в литературе описан случай развития субарахноидального, субдурального и внутримозгового кровоизлияний, источником которых явился гиперпластический процесс в области перенесенной в прошлом костно-пластической трепанации черепа [246].
Таким образом, множество источников СГ представляет собой широкий спектр повреждений интактных и патологически измененных анатомических структур, а также посттравматических и нетравматических патологических образований. При этом под повреждением следует понимать любое нарушение целостности анатомической структуры или ее твердофазного патологического образования, прямо или опосредованно приводящее к кровотечению в субдуральное пространство. Согласно данному определению, наряду с исключительно травматическими нарушениями тканей головы повреждениями также необходимо считать некрозы опухолей, разрывы аневризм и варикозных расширений, капсул подострых и хронических гематом и абсцессов, дефекты трансплантатов. Напротив, к числу повреждений не относятся какие-либо изменения объема или пространственного расположения внутричерепных скоплений крови, ликвора, воздуха или экссудата. В том случае, если указанные внутричерепные скопления жидкости или газа сопровождаются вторичными нарушениями тканей головы, последние должны расцениваться как повреждения соответствующих анатомических структур.
В реализации любого повреждения независимо от характера повреждаемой нормальной интактной или патологически измененной анатомической структуры, а также посттравматического или нетравматического патологического образования могут принимать участие как внешние механические, так и эндогенные механические и немеханические факторы. Это следует учитывать при судебно-медицинской экспертной оценке генеза СГ, который в зависимости от наличия и вида механического воздействия подразделяется на 3 варианта:
- травматический (прямой или включающий цепь осложнений);
- самопроизвольный (нетравматический)
- смешанный.
Инициализацией алгоритма экспертного определения генеза СГ должна являться идентификация поврежденной анатомической структуры, послужившей источником кровотечения в субдуральное пространство, выяснение ее характера (нормальное или патологическое образование) и степени развития в нем патологических изменений.
Проведенный обзор литературы и анализ собственных данных позволяет предложить следующую классификационную схему потенциальных источников травматических и самопроизвольных СГ:
Классификация потенциальных источников СГ
| 1. | Нормальные анатомические структуры. | |||
| 1.1. | Интактные. | |||
| 1.1.1. | Собственно интактные. | |||
| 1.1.2. | При невазопатических геморрагических диатезах. | |||
| 1.1.2.1. | При тромбоцитопениях. | |||
| 1.1.2.2. | При тромбоцитопатиях. | |||
| 1.1.2.3. | При коагулопатиях. | |||
| 1.1.2.4. | При комбинированных дефектах гемостаза. | |||
| 1.2. | Патологически измененные. | |||
| 1.2.1. | С воспалительными изменениями. | |||
| 1.2.1.1. | При пахименингитах. | |||
| 1.2.1.2. | При лептоменингитах. | |||
| 1.2.1.3. | При энцефалитах. | |||
| 1.2.1.4. | При комбинированных локальных и системных воспалительных процессах. | |||
| 1.2.2. | При невоспалительных процессах. | |||
| 1.2.2.1. | При кранио-церебральных диспропорциях. | |||
| 1.2.2.2. | При церебральной атрофии. | |||
| 1.2.2.3. | При самопроизвольной внутричерепной гипотензии. | |||
| 1.2.2.4. | При иных и комбинированных невоспалительных патологических процессах. | |||
| 2. | Патологические анатомические структуры. | |||
| 2.1. | Посттравматические. | |||
| 2.1.1. | Травматические внутричерепные аневризмы. | |||
| 2.1.1.1. | Истинные. | |||
| 2.1.1.2. | Ложные. | |||
| 2.1.2. | Артерио-венозные фистулы. | |||
| 2.1.3. | Арахноидальные кисты. | |||
| 2.1.4. | Капсулы СГ. | |||
| 2.1.5. | Внутричерепные рубцовые изменения. | |||
| 2.2. | Нетравматические. | |||
| 2.2.1. | Арахноидальные кисты. | |||
| 2.2.1.1. | Врожденные. | |||
| 2.2.2.2. | Приобретенные. | |||
| 2.2.2. | Внутричерепные аневризмы. | |||
| 2.2.3. | Сосудистые мальформации. | |||
| 2.2.4. | Опухоли. | |||
| 2.2.4.1. | Первичные. | |||
| 2.2.4.1.1. Дуральные опухоли. | ||||
| 2.2.4.1.2. Церебральные опухоли. | ||||
| 2.2.4.2. | Вторичные. | |||
| 2.2.4.2.1. Метастатические. | ||||
| 2.2.4.2.2. Контактно-инфильтративные. | ||||
| 2.2.5. | Иные патологические образования. | |||
Читать далее раздел "2.3. Ятрогенные интракраниальные субдуральные гематомы"⇒

