Вы здесь
К вопросу о выделении геномной днк из содержимого костного канала фрагментов трубчатых костей
Publication in electronic media: 12.11.2011 under http://journal.forens-lit.ru/node/494
Publication in print media: Актуальные вопросы судебной медицины и экспертной практики, Барнаул-Новосибирск 2011 Вып. 17
Г.В. Червоная, С.Г. Хайдаршин
г. Барнаул
Тема экстракции геномной ДНК из костной ткани в практике судебно-медицинской экспертизы вещественных доказательств в последнее время становится всё более актуальной. В процессе выделения ДНК из биологического материала основная задача – хорошо диспергировать ткань, чтобы разрушить клетки, а затем отделить ДНК от сопутствующих ей белков и посторонних примесей для получения препарата с чистотой, пригодной для постановки ПЦР. С мягкими тканями в большинстве случаев проблем не возникает, а вот выделение ДНК из кости гораздо более трудоемко и требует специальных подходов.
Общепринятая методика получения ДНК из костной ткани предполагает очень длительный (в течение нескольких дней) процесс пробоподготовки, декальцификации и очистки ДНК с использованием фенол-хлороформной экстракции. К недостаткам метода нужно отнести очень высокую токсичность (использование в процессе выделения агрессивных органических соединений). Он довольно трудоемок, при этом возможны значительные потери ДНК, остаточные загрязнения протеинами, фенолом и хлороформом – сильными ингибиторами ПЦР. В конечном итоге в большинстве случаев приходится сталкиваться с проблемой нестабильности конечного результата – результаты либо отрицательные, либо труднотрактуемые.
С целью поиска альтернативных методов выделения, нами была использована методика исследования содержимого костного канала фрагментов трубчатых костей в качестве биологического материала для выделения геномной ДНК из кости. Мы испытывали различные варианты нефенольных методов выделения ДНК:
- метод с использованием ионообменной смолы Chelex 100. Процедура заключается в очистке ДНК от металлосодержащих соединений и протеинов путем кипячения в присутствии Chelex 100, затем супернатант непосредственно добавляют в ПЦР-смесь;
- метод с использованием набора реагентов DiatomTM DNA Prep 200 (Москва), основанного на использовании лизирующего реагента с гуанидинтиоцианатом, который предназначен для лизиса клеток, солюбилизации клеточного дебриса, а также для денатурации клеточных нуклеаз. В присутствии лизирующего реагента ДНК активно сорбируется на носителе NucleoSTM, с которого она легко снимается с помощью элюирующего буфера;
- метод с использованием набора реагентов Diamond DNA Genomic DNA Extraction Kit for Animal Tissue Samples, в состав лизис-буфера которого входят компоненты предотвращающие адсорбцию ДНК на стенках пробирки, ее окисление и эффективно связывающие полифенолы. ДНК остается в растворе, а адсорбция примесей, ингибирующих ПЦР происходит с помощью сорбента, частицы которого имеют нанометровые размеры и не взаимодействуют с ДНК, что предотвращает ее механическую и химическую деградацию. Дополнительная очистка ДНК от белков, полисахаридов и компонентов лизис-буфера происходит вследствие селективного осаждения молекул ДНК высокоэффективным осадителем.
Сравнительный анализ преимуществ и недостатков этих методов проводился с учетом: способности ДНК к амплификации; сохраняемости проб выделенной ДНК; длительности и трудоемкости процедуры пробоподготовки и экстрагирования; необходимости использования токсических веществ; материальных затрат.
Исследовались кости от трупов, находящиеся в архиве нашего отделения, причина смерти которых не установлена из-за гнилостных изменений, промерзания и обгорания.
Исследуемый материал готовился следующим образом: делались соскобы с внутренней поверхности трубчатых костей, содержимое высушивалось на отрезке марлевого бинта.
Выделение хромосомной ДНК проводилось с использованием трех вышеуказанных методик.
Амплификацию изучаемых полиморфных последовательностей ДНК методом ПЦР проводили в монолокусном формате, продукты полимеразной цепной реакции фракционировали электрофоретически в 8% ПААГ в денатурирующих условиях и анализировали в проходящем свете после окрашивания нитратом серебра с использованием коммерческих наборов НПФ “АТГ-Биотех” Москва. При этом были получены положительные результаты. В качестве примеров приводим 4 наблюдения.
Наблюдение 1: 03.07.2010г. в результате взрыва на военном полигоне произошла гибель двух и более лиц, в отделение были доставлены три фрагмента бедренной кости от человеческих останков, наружная поверхность которых сильно обуглена, с наложениями вещества черного цвета, а содержимое костных каналов желтого и красновато-серого цвета. В результате исследования получены препараты ДНК мужской половой принадлежности, пригодные для идентификационного анализа (см. рис. 1).
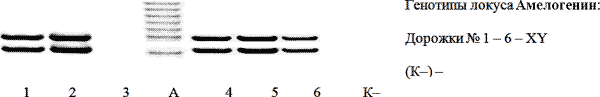
Рис. 1. Электрофореграмма амплифицированных фрагментов ДНК локуса Амелогенина содержимого костных каналов трех фрагментов бедренной кости от человеческих останков при взрыве на военном полигоне, выделенных: с использованием Chelex 100 – дорожки 1, 2, 3; набором реагентов Diamond DNA – дорожки 4, 5, 6 (соответственно).
Наблюдение 2: 09.04.2010г. в отделение доставлен фрагмент бедренной кости от трупа неустановленного мужчины, погибшего при пожаре.
Наблюдение 3: 01.04.2010г. в ходе тушения пожара в жилом доме обнаружены останки. Причина смерти не установлена из-за выраженного обугливания трупа.
Наблюдение 4: 01.04.2008г. в лабораторию прислан фрагмент бедренной кости от трупа неизвестного мужчины, обнаруженного на улице. Причина смерти не установлена из-за выраженного гниения трупа. Дата смерти – осень–зима 2007-2008гг..
В процессе исследования в феврале 2011г. из содержимого костных каналов фрагментов трубчатых костей наблюдений 2, 3, 4 выделены индивидуальные препараты ДНК мужской половой принадлежности и установлены их генотипические аллельные комбинации (см. рис. 2).

Рис. 2. Электрофореграммы амплифицированных фрагментов ДНК STR – локусов D13S317 и F13A01: содержимого костного канала фрагмента бедренной кости от трупа неустановленного мужчины, погибшего при пожаре (наблюдение 2) – дорожка 1; содержимого костного канала фрагмента трубчатой кости останков, обнаруженных в ходе тушения пожара в жилом доме (наблюдение 3) – дорожка 2; содержимого костного канала фрагмента бедренной кости от трупа неизвестного мужчины, обнаруженного на улице (наблюдение 4) – дорожка 3.
В результате исследования были сделаны следующие выводы:
- исследование содержимого костного канала фрагментов трубчатых костей в качестве биологического материала для выделения геномной ДНК позволяет исключить длительный и трудоемкий процесс пробоподготовки в сравнении с исследованием компактного вещества костной ткани;
- сама процедура выделения с использованием вышеперечисленных наборов проста в исполнении, предполагает малое количество стадий, непродолжительна по времени (процесс выделения занимал не более двух часов), экономична – позволяет затрачивать минимальные материальные ресурсы, и безопасна (исключает присутствие агрессивных органических соединений – фенола, хлороформа, толуола).
При сравнительном исследовании трех методик выявлено, что метод выделения ДНК с использованием Chelex 100 в большинстве случаев не пригоден для работы с костной тканью, особенно гнилостно измененной, содержащей примеси, которые невозможно удалить с помощью ионообменников. Кроме того, многие микроорганизмы, размножающиеся в процессе гниения, не поддаются разрушению простым кипячением. Срок хранения выделенных таким образом препаратов ДНК непродолжителен.
Два другие набора позволяют получить высокомолекулярный, чистый препарат ДНК, пригодный для идентификационного анализа, причем продолжительность хранения препаратов достаточно высока – более 1 года (при -20°С). Набор реагентов Diamond DNA позволяет получить низкие потери ДНК при экстракции, нанометровые частицы сорбента его нетоксичны, инертны и не ингибируют ПЦР, в отличие от гуанидинтиоцианата, который токсичен и даже следовые количества его в элюате могут ингибировать ферментативные реакции (см. рис. 3).

Рис. 3. Электрофореграмма амплифицированных фрагментов ДНК локуса Амелогенина содержимого костных каналов трех фрагментов бедренных костей, выделенных: с использованием Chelex 100 – дорожки 1, 2, 3; набором реагентов DiatomTM DNA – дорожки 4, 5, 6; набором реагентов Diamond DNA – дорожки 7, 8, 9;
Маркеры молекулярного веса: А – локус специфические аллельные маркеры, (К+) – положительный контрольный образец ДНК, (К–) – отрицательный контроль без ДНК.
Таким образом, методы исследования содержимого костных каналов трубчатых костей с помощью наборов DiatomTM DNA и Diamond DNA пригодны для экспертного применения, просты, безопасны, экономичны, позволяют проводить эффективную экстракцию ДНК и могут быть использованы при невозможности получения образца жидкой крови трупа.

