Вы здесь
Химико-токсикологическое исследование кеторолака
Publication in electronic media: 11.11.2011 under http://journal.forens-lit.ru/node/478
Publication in print media: Актуальные вопросы судебной медицины и экспертной практики, Барнаул-Новосибирск 2011 Вып. 17
Л.Е. Кудрикова , В.А. Кодрян , Е.И. Секирко , Н.А. Подберезко
г. Барнаул
Кеторолак - (±) - 5 - бензоил - 2, 3 - дигидро - 1H - пирролизин - 1 - карбоновая кислота (соль с 2 - амино - 2 - гидроксиметил - 1, 3 - пропандиолом) применяется как нестероидное противовоспалительное средство, оказывает выраженное анальгезирующее действие, обладает также противовоспалительным и умеренным жаропонижающим действием.
Кеторолак широко используется и при определенных условиях может вызвать отравления, однако, сведений по химико-токсикологическому анализу препарата в литературе недостаточно.
Целью исследования является разработка возможности обнаружения и количественного определения кеторолака в биоматериале. Идентификацию препарата проводили методами спектрофотометрии в УФ-области (УФ-СФМ), ТСХ и ВЭЖХ. При исследовании препарата методом УФ-СФМ установлено, что спектры препарата не зависят от рН среды, максимумы поглощения кислого и щелочного растворов находятся в диапазонах длин волн 253-256 нм и 320-322 нм; спиртового раствора – 247 и 322 нм. Удельные коэффициенты поглощения кислого раствора – 234±2 и 552±3; щелочного раствора 197±1, и 552±3, спиртового раствора – 218±1и 532±3 соответственно.
В литературных источниках отсутствуют данные по определению кеторолака методом ТСХ в присутствии других веществ кислотного характера. Мы провели исследование препарата в системе растворителей для веществ кислотного характера: хлороформ-ацетон (9:1) и предложили новую хроматографическую систему: хлороформ – ацетон – метанол - 25% аммиак (10:10:4:1) на пластинках «Сорбфил». Детектировали вещества 1% раствором ртути (II) сульфата и раствором дифенилкарбазона в хлороформе. Производные барбитуровой кислоты и кеторолак обнаруживаются в виде фиолетовых пятен. Полученные результаты приведены в табл. 1 и 2.
Таблица 1 Значения Rf кеторолака и производных барбитуровой кислоты в системе растворителей хлороформ-ацетон (9:1)
| Вещество | Значения Rf | ||||||
| I | II | III | IV | V | среднее | ΔX | |
| Фенобарбитал | 0,25 | 0,27 | 0,3 | 0,24 | 0,27 | 0,27 | 0,02 |
| Барбитал | 0,36 | 0,37 | 0,4 | 0,35 | 0,41 | 0,38 | 0,02 |
| Барбамил | 0,47 | 0,49 | 0,5 | 0,45 | 0,49 | 0,48 | 0,02 |
| Бензонал | 0,68 | 0,7 | 0,71 | 0,66 | 0,69 | 0,69 | 0,01 |
| Кеторолак | 0,13 | 0,12 | 0,12 | 0,11 | 0,14 | 0,12 | 0,01 |
Таблица 2 Значения Rf кеторолака и производных барбитуровой кислоты в системе хлороформ – ацетон – метанол – 25% раствор аммиака (10:10:4:1).
| Вещество | Значения Rf | ||||||
| I | II | III | IV | V | среднее | ΔX | |
| Фенобарбитал | 0,45 | 0,44 | 0,46 | 0,43 | 0,42 | 0,44 | 0,02 |
| Барбитал | 0,36 | 0,36 | 0,37 | 0,35 | 0,34 | 0,36 | 0,01 |
| Барбамил | 0,61 | 0,60 | 0,62 | 0,59 | 0,60 | 0,60 | 0,01 |
| Бензонал | 0,52 | 0,50 | 0,51 | 0,53 | 0,52 | 0,52 | 0,01 |
| Кеторолак | 0,29 | 0,30 | 0,32 | 0,28 | 0,31 | 0,30 | 0,02 |
При использовании указанных систем растворителей по значению Rf можно отличить кеторолак от барбитуратов.
Исследования проводили с помощью жидкостного хроматографа марки «Милихром А–02». Использовалась хроматографическая колонка размером 75×2 мм, заполненная сорбентом «Нуклеосил С18». Элюирование проходило в градиентном режиме: элюент А – 0,1% раствор трифторуксусной кислоты, элюент В – 100% ацетонитрил, концентрация компонента В изменялась от 5 до 75% на 2250 мкл подвижной фазы, скорость потока составляла 150 мкл/мин, измерение проводили при длинах волн 200, 220, 254, 300 нм. Идентифицировали вещества по временам удерживания и спектральным соотношениям. Результаты представлены в табл. 3 и рис. 1.
Таблица 3 Времена удерживания и спектральные соотношения кеторолака и некоторых других веществ кислотного характера
| № | Наименование вещества | Время удерживания (мин) | Спектральные соотношения D λ1\λ2 | ||
| 220/200 | 254/200 | 300/200 | |||
| 1 | Барбитал | 5,4 | 0,450 | 0,003 | 0,002 |
| 2 | Фенобарбитал | 7,5 | 0,300 | 0,033 | 0,002 |
| 3 | Кислота салициловая | 7,9 | 0,154 | 0,024 | 0,118 |
| 4 | Барбамил | 8,8 | 0,401 | 0,010 | 0,008 |
| 5 | Кеторолак | 9,9 | 0,375 | 0,409 | 0,880 |
| 6 | Бензонал | 12,5 | 0,198 | 0,365 | 0,025 |
| 7 | Бензобамил | 13,7 | 0,224 | 0,469 | 0,033 |
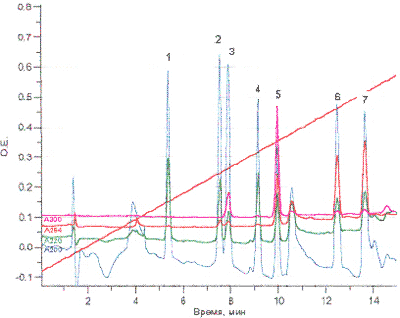
Рис. 1. Исследование кеторолака и ряда других веществ кислотного характера методом ВЭЖХ: 1 – барбитал, 2 – фенобарбитал, 3 – салициловая кислота, 4 – барбамил, 5 – кеторолак, 6 – бензонал, 7 – бензобамил.
Количественное определение кеторолака, извлеченного из биологического материала, проводили методами спектрофотометрии в УФ-области спектра и ВЭЖХ.
Кеторолак изолировали из внутренних органов нейтральным ацетоном по методике (Карташов В.А.и соавт.,1988). Для этого готовили модельные образцы, представляющие собой искусственную смесь измельченной ткани печени массой 5 г с препаратом кеторолак в количестве 1 мг. Кеторолак проявляет кислотные свойства благодаря наличию в химической структуре карбоксильной группы, константа ионизации составляет pKa=3,49, поэтому извлекается из кислого водно-ацетонового раствора. Очистку полученного извлечения проводили методом ТСХ, использовали систему растворителей хлороформ – ацетон – метанол – 25% раствор аммиака (10:10:4:1). Кеторолак с пластинки элюировали боратным буферным раствором (рН 10).
Идентификация кеторолака проводилась вышеуказанными методами (УФ-СФМ, ТСХ и ВЭЖХ). Характеристики препарата, извлеченного из биологического материала, совпали с таковыми, установленными для стандартного препарата «Кеторолак».
Для количественного определения измеряли оптическую плотность полученного элюата при длине волны 322 нм, содержание препарата рассчитывали по стандартному раствору. Часть элюата исследовали методом высокоэффективной жидкостной хроматографии в описанных выше условиях, измеряли площади пиков, расчет проводили по калибровочному графику, используя обрабатывающую программу «МультиХром для Windows». Результаты количественного определения кеторолака, полученные с использованием методов УФ-СФМ и ВЭЖХ, представлены в табл. 4.
Таблица 4 Количественное определение кеторолака, извлеченного из биологического материалас помощью нейтрального ацетона
| Метод определения | Выход кеторолака в % | ||||
| № Пробы | I | II | II | среднее | ΔX |
| УФ-СФМ | 58,0 | 60,0 | 57,0 | 58,3 | 3,8 |
| ВЭЖХ | 52,0 | 56,0 | 51,0 | 53,0 | 6,6 |
При использовании УФ-СФМ обнаружено 58,3% кеторолака от добавленного к биологическому объекту, а методом ВЭЖХ выход ниже – 53,0%. Более высокий выход, полученный методом УФ-СФМ, вероятно, объясняется присутствием примесей в элюате, которые в процессе хроматографирования отделяются.
Таким образом, разработана методика химико-токсикологического анализа кеторолака с использованием комплекса физико-химических методов: СФМ, ТСХ и ВЭЖХ, которая позволяет обнаружить и количественно определить кеторолак в биоматериале, а также в случаях комбинированных отравлений совместно с веществами кислотного характера.
Список литературы
- Карташов В.А., Кнауб В.А., Чернова Л.В. Изолирование азотсодержащих органических оснований из ткани печени // Судеб. – мед. экспертиза. – 1988. № 4. – С.31-33.

