Вы здесь
Изолирование и идентификация ципрогептадина при судебно-химическом исследовании
Publication in electronic media: 12.11.2011 under http://journal.forens-lit.ru/node/488
Publication in print media: Актуальные вопросы судебной медицины и экспертной практики, Барнаул-Новосибирск 2011 Вып. 17
И.В. Стаценко, Н.А. Заздравных, Л.Г. Воронкова
г. Барнаул
Ципрогептадин – торговое название перитол – 4-(5-Дибензол(а, d) циклогептатриенилиден)-1- метилпиперидина гидрохлорид. Препарат обладает антигистаминной активностью, характеризуется также антихолинэстеразными свойствами (Машковский М.Д., 2005). Ципрогептадин оказывает выраженное седативное действие, способствует потенцированию наркотиков, обладает противорвотным и выраженным противовоспалительным действием. Препарат выпускается в таблетках по 4 мг, сироп (для детей) во флаконах по 100 мл (в 1 мл 0,4 мг препарата). Хранение: Список Б.
В последнее время ципрогептадин широко применяется в лечебной практике и поэтому представляет интерес для химико-токсикологического исследования. Нами была поставлена задача изучения изолирования и идентификации ципрогептадина из биологических объектов общепринятыми в судебной химии методами.
Ципрогептадин – белый с желтоватым оттенком кристаллический порошок. Растворимость: 1 часть препарата в 275 частей воды, 35 частях этанола, 16 частях хлороформа, 1,5 частях метанола. Не растворим в эфире.
Экспериментальная часть
В настоящее время для идентификации и количественного определения веществ широко используется метод высокоэффективной жидкостной хроматографии (ВЭЖХ), благодаря высокой чувствительности и специфичности. При изучении ципрогептадина мы использовали этот метод. Исследование спиртового раствора ципрогептадина проводили на микроколоночном жидкостном хроматографе «Милихром А-02» с УФ-детектором производства ЗАО «Эконова» (Новосибирск). Хроматограмма ципрогептадина представлена на рис. 1.
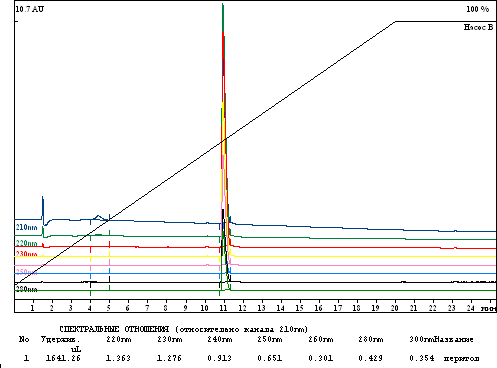
Рис. 1. Хроматограмма ципрогептадина.
Хроматографирование проводилось в следующих условиях: колонка «Prontosil 120-5 С18 Q» (2х75 мм), температура колонки 35 0С, элюент «А» - 0,1% раствор трифторуксусной кислоты, элюент «Б» - ацетонитрил. Градиент от 0% до 100% с объемом 3000 мкл, 100% – 3800 мкл, скорость потока 150 мкл/мин, объем вводимой пробы 4 мкл. Детектирование осуществлялось при следующих длинах волн: 210, 220, 230, 240, 250, 260, 280, 300нм. Обработка осуществлялась программой «Мультихром Спектр». Идентификацию проводили по времени удерживания, объему удерживания и спектральным отношениям относительно базовой длины волны 210 нм.
Из приведенной хроматограммы следует, что объем удерживания ципрогептадина составляет 1641 мкл/ мин, время удерживания 10,8 минут. Спектральные отношения пика с объемом удерживания 1641 составили соответственно: 220 нм – 1,363, 230 нм – 1,276, 240 нм – 0,913, 250 нм – 0,651, 260 нм – 0,301, 280 нм – 0,429, 300 нм – 0,354. Таким образом, метод ВЭЖХ позволяет надежно идентифицировать ципрогептадин по параметрам удерживания и спектральным отношениям.
Для подбора наиболее эффективного метода изолирования ципрогептадина была изучена его способность экстрагироваться в различных условиях (Информационное письмо, 1991). Изолирование ципрогептадина из водного раствора проводилось:
- хлороформом рН = 9, 10, 11
- этилацетатом при рН= 9, 10, 11
- после кислотного гидролиза при рН= 9, 10, 11 смесью хлороформ - н-бутанол (9:1)
Для количественного определения ципрогептадина нами был построен градуировочный график на ВЭЖХ из раствора очищенного высушенного ципрогептадина. Данные по проценту изолирования вышеуказанными методами представлены в табл. 1.
Таблица 1 Расчет процента изолирования ципрогептадина в зависимости от метода изолирования.
| Изолирование | Реакция среды рН | Количество добавленного ципрогептадина, мг | Выход в мг | Выход в % | Изолировано в среднем в % |
| Хлороформ | 9,0 | 8,0 | 2,5 | 31,3 | 35 |
| 10,0 | 8,0 | 3,1 | 38,8 | ||
| 11,0 | 8,0 | 2,8 | 35,0 | ||
| Этилацетат | 9,0 | 8,0 | 7,1 | 88,8 | 91 |
| 10,0 | 8,0 | 7,5 | 93,8 | ||
| 11,0 | 8,0 | 7,25 | 90,6 | ||
| Изолирование после кислотного гидролиза: хлороформ-н-бутанол | 9,0 | 8,0 | 1,3 | 16,3 | 17,5 |
| 10,0 | 8,0 | 1,7 | 21,3 | ||
| 11,0 | 8,0 | 1,2 | 15,0 |
Анализируя данные таблицы можно сделать вывод о том, что наиболее эффективным методом изолирования является метод экстракции этилацетатом при рН = 10.
Для изучения изолирования ципрогептадина из биоматериала была приготовлена модельная смесь крови с препаратом. При этом рН среды доводилась боратным буфером (рН 10) и проводилась экстракция этилацетатом (жидкостно-жидкостная экстракция). Результаты приведены в табл. 2.
Таблица 2 Оценка примененного метода изолирования ципрогептадина из крови
| Количество ципрогептадина, добавленное в кровь | Обнаруженная концентрация в мг | Процент извлечения от введенного количества, в % | Метрологическая характеристика |
| 0,001 | 0,00082 | 82 | Х= 82,75 S= 2,5 Sх= 1,25 а= 3,98 |
| 0,003 | 0,0024 | 80 | |
| 0,005 | 0,0043 | 86 | |
| 0,007 | 0,0058 | 83 |
Х – среднее арифметическое, S – стандартное отклонение, Sх – стандартная ошибка, а – доверительный интервал. Граница доверительного интервала с надежностью 82,75% ± 3,98.
Для идентификации ципрогептадина использовались общепринятые цветные реакции (табл.3).
Таблица 3 Сравнительная характеристика реакций окрашивания ципрогептадина и алкалоидов опия
| Наименование вещества | Реактив Драгендорфа | Реактив марки | Йод-платинат | Реактив Фреде | Концентр. серная кислота |
| Ципрогептадин | красно-оранжевое | фиолетовое переходящее в серо-зеленое | фиолетовое | фиолет. переход. в бурое | Фиолетовое |
| Морфин | красно-оранжевое | красно-фиолетовое | темно-синее | фиолет. | нет окрашивания |
| Кодеин | красно-оранжевое | фиолетовое | фиолетово-черное | фиолет.-зеленое | нет окрашивания |
Проанализировав особенности реакций окрашивания ципрогептадина и алкалоидов опия с различными реактивами, можно сделать вывод об их схожести, что затрудняет дифференциацию этих веществ при судебно - химическом исследовании (Заздравных Н.А. с соавт., 2002).
ТСХ исследование Rf ципрогептадина и алкалоидов опия в следующих системах растворителей: С1-хлороформ, 96%, этанол, 25% раствор аммиака (20:5:1); С2 – хлороформ-ацетон (9:1), С3- этилацетат, метанол, 25% раствор аммиака (85:10:5), (табл. 4).
Таблица 4 Характеристика Rf в различных системах
| Наименование вещества | Системы растворителей | ||
| С1 (Rf) | С2 (Rf) | С3 (Rf) | |
| ципрогептадин | 0,81 | 0,22 | 0,65 |
| Морфин | 0,29 | 0,20 | 0,19 |
| Кодеин | 0,45 | 0,30 | 0,30 |
При повторном хроматографировании на «Милихроме А02» 4 мкл элюата ципрогептадина снимали УФ-спектр вещества, соответствующий указанному выше пику вблизи его максимума (рис.2).
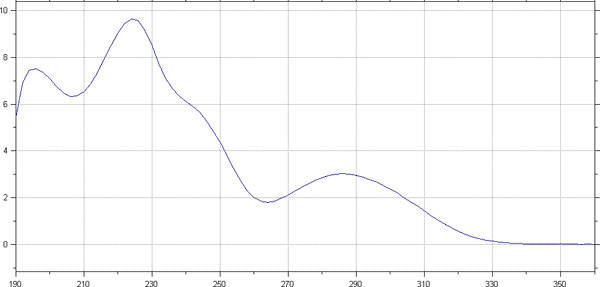
Рис. 2 УФ-спектр поглощения ципрогептадина (спектральная кривая).
Ципрогептадин имеет выраженный максимум абсорбции при 222, 286 нм. Для установления удельного показателя поглощения был применен регистрирующий спектрофотометр «UVmini – 1240». Нами был установлен удельный показатель поглощения ципрогептадина Е1%1см, который составил в кислой среде при длине волны 286 нм - 433, в щелочной среде при длине волны 284 нм – 377.
В моче больной, принявшей внутрь 0,008 мг ципрогептадина, было изолировано этилацетатом при рН=10 (боратный буфер), идентифицировано и определено 0,001 мг% вещества.
Таким образом, из биологических жидкостей 90% ципрогептадина извлекается этилацетатом при рН = 10. Идентификация ТСХ и ВЭЖХ.
Список литературы
- Заздравных Н.А., Стаценко И.В., Воронкова Л.Г. Изучение возможности определения некоторых антигистаминных препаратов при судебно - химическом исследовании. //Вестник Межрегиональной Ассоциации «Здравоохранение Сибири». Новосибирск 2002г. стр. 73.
- Информационное письмо об определении морфина при судебно- химическом исследовании трупного материала. МЗ СССР. 1991г. стр. 7.
- Машковский М.Д. Лекарственные средства. Пособие для врачей. Изд.15, 2005. 283с.

