Вы здесь
Химико-токсикологическое исследование тропикамида
Publication in electronic media: 12.11.2011 under http://journal.forens-lit.ru/node/491
Publication in print media: Актуальные вопросы судебной медицины и экспертной практики, Барнаул-Новосибирск 2011 Вып. 17
Л.М. Федосеева, Д.Д. Даутова, Н.Н. Кнауб, Л.Г. Воронкова, В.А. Кодрян
г. Барнаул
Злоупотребление наркотическими средствами, психотропными и сильнодействующими веществами является острой социальной проблемой. В Алтайском крае, согласно данным предоставленным начальником регионального управления Федеральной службы РФ по контролю за оборотом наркотиков, общее число зарегистрированных больных наркоманией составляет более 12 тыс. человек, 90% которых лица 20-39 лет. В последнее время среди наркоманов стал популярен новый «аптечный наркотик» – тропикамид. Этот препарат широко используют наркозависимые люди как фармакологическую добавку к героину, а также применяют тропикамид и в «чистом виде». Тропикамид доступный, сравнительно дешевый препарат. Немедицинское употребление тропикамида приобретает угрожающие масштабы. По результатам социологического опроса наркозависимых лиц, проведенных в апреле 2009 года, из 100 респондентов – 80 отметили, что хотя бы раз использовали тропикамид для разведения героина.
В практике работы токсикологической лаборатории встречаются случаи отравлений тропикамидом. Возможность определения тропикамида в биологическом материале не изучена. В настоящей работе предложена схема химико-токсикологического определения тропикамида.
Общая характеристика тропикамида
Структурная формула, химическое название: N-Этил-2-фенил-N-(4-пиридилметил) гидракриламид. Синонимы: Мидриацил, Мидрум.
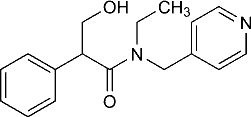
Тропикамид представляет собой белый кристаллический порошок с температурой плавления 96-97°С, хорошо растворим в воде, этиловом спирте и в хлороформе. Лекарственная форма: 0,5% или 1% раствор во флаконах-капельницах, бесцветная, прозрачная жидкость.
Тропикамид применяется в офтальмологии в диагностических целях, когда необходимо вызвать мидриаз. Тропикамид подобен по действию другим м-холинолитическим препаратам, например, таким как атропин. При передозировке тропикамида возникают клинические симптомы, которые проявляются в течение часа после приема: возбуждение, атаксия, спутанность сознания, делирий, галлюцинации, возможны сонливость, угнетение дыхания и кома, иногда отравления могут сопровождаться эпилептическими припадками. Тропикамид наркотическим эффектом не обладает, но способен пролонгировать действие опиатов. В последнее время тропикамид стали применять как самостоятельное средство для одурманивания. У наркоманов, употребляющих тропикамид, кожа в течение считанных недель становится цвета жёлтого воска, гемоглобин падает до 32 г/л.
Для идентификации тропикамида использовали тонкослойную хроматографию (ТСХ), спектрофотометрию (СФМ), высокоэффективную жидкостную хроматографию (ВЭЖХ), газо-жидкостную хроматографию с масс-селективным детектором (ГЖХ-МС).
ТСХ исследование: На хроматографическую пластинку тропикамид наносили в виде основания и помещали в камеру, предварительно насыщенную парами растворителей. Проявитель - реактив Драгендорфа. В эксперименте использовали следующие системы:
Ацетон – 25% аммиак (9:1); ацетон – хлороформ (9:1); ацетон – гексан – диэтиламин (10:10:1); хлороформ – ацетон – 25% аммиак (15:15:1); диэтиловый эфир – ацетон – 25% аммиак (10:1:0,1); бензол –96% этанол – диэтиламин (9:1:1); хлороформ – 96% этанол – 25% аммиак (80:20:4); ацетон (100%) без насыщения; этилацетат-метанол- 25% аммиак (85:10:5)
Полученные результаты хроматографического исследования тропикамида представлены в табл. 1.
Таблица 1 Значения показателей Rf тропикамида в различных хроматографических системах
| Опыт | Хроматографические системы | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 1 | 0,79 | 0,48 | 0,62 | 0,55 | 0,00 | 0,69 | 0,81 | 0,70 | 0,74 |
| 2 | 0,8 | 0,48 | 0,59 | 0,56 | 0,22 | 0,63 | 0,84 | 0,7 | 0,74 |
| 3 | 0,8 | 0,48 | 0,58 | 0,57 | 0,2 | 0,7 | 0,88 | 0,70 | 0,74 |
| X±ΔХ | 0,79±0,01 | 0,48±0 | 0,59±0,05 | 0,56±0,02 | 0,20±0,03 | 0,67±0,09 | 0,84±0,08 | 0,70±0 | 0,74±0 |
| Sх | 0,003 | 0 | 0,01 | 0,006 | 0,009 | 0,021 | 0,02 | 0 | 0 |
| Е | 1,79 | 0 | 8,66 | 4,43 | 18,65 | 13,96 | 10,34 | 0 | 0 |
Как видно из таблицы оптимальными системами для тропикамида являются смеси растворителей 2-4, так как значение Rf составило 0,48; 0,59; 0,56 соответственно. В случае комбинированных отравлений тропикамидом с алкалоидами опия для разделения веществ целесообразно использовать системы 6 и 9 (табл. 2).
Таблица 2 Значения показателей Rf тропикамида и алкалоидов опия в частных хроматографических системах
| № | Система растворителей | Значения Rf | ||
| тропикамид | морфин | кодеин | ||
| 1. | Этилацетат - метанол – 25% раствор аммиака (17:2:1) | 0,740±0 | 0,33±0,011 | 0,47±0,012 |
| 2. | Бензол-этанол-диэтиламин (9:1:1) | 0,67±0,009 | 0,39±0,022 | 0,53±0,021 |
СФМ исследование: Для исследования использовали спиртовые растворы тропикамида с концентрацией действующего вещества 10 мкг/мл. СФМ исследование проводили на спектрофотометре «Varian – Carry» в автоматическом режиме в диапазоне от 200 до 400 нм. Спектральные характеристики снимали в нейтральной, кислой и щелочной средах, добавляя к спиртовому раствору тропикамида 6н. соляной кислоты или 10% спиртового раствора гидроксида натрия.
Тропикамид имеет максимумы поглощения при длинах волн 210 нм, 255-258 нм. В спектрах поглощения тропикамида в нейтральной, кислой и щелочной средах наблюдали незначительные изменения: сдвиг в длинноволновую область (212, 258 нм) – в щелочной среде и незначительный гипсохромный сдвиг в кислой среде – 204, 254 нм. Удельный показатель поглощения тропикамида в 0,1н. соляной кислоте Е 1% в 1 см=180.(Аляутдин Р.Н. и соавт., 2007).
Определение тропикамида методом ГЖХ проводили с использованием газового хроматографа «Angilent Technologies 6890N Network GC System» с масс-селективным детектором модели «5973» в режиме ионизации электронным ударом (70 эВ), c автоматическим жидкостным дозатором модели «7683 В Series», при следующих условиях: колонка - кварцевая капиллярная «НР-5MS (30м х 0,252 мм», (толщина пленки фазы – 0,25 мкм); температура инжектора – 280°C; температура интерфейса детектора – 310°С; температура термостата колонки от 100°С до 280°С; увеличение температуры со скоростью 10 град/мин; газ-носитель – гелий; объем вводимой пробы – 1 мкл; деление потока 1:40.
Для полученных хроматограмм рассчитывали индексы удерживания компонентов анализируемых веществ и регистрировали их масс-спектры. Регистрацию масс-спектров компонентов хроматограмм проводили в режиме по полному ионному току. Полученные масс-спектры сравнивали с библиотечными масс-спектрами. Анализировали идентифицированные пики веществ с процентом вероятности не менее 80%. Как видно из представленной хроматограммы, тропикамид имеет время удерживания 11,7 мин. Основные характеристические ионы тропикамида - 92, 254,65,163, 121m/z (рис. 1 и 2).
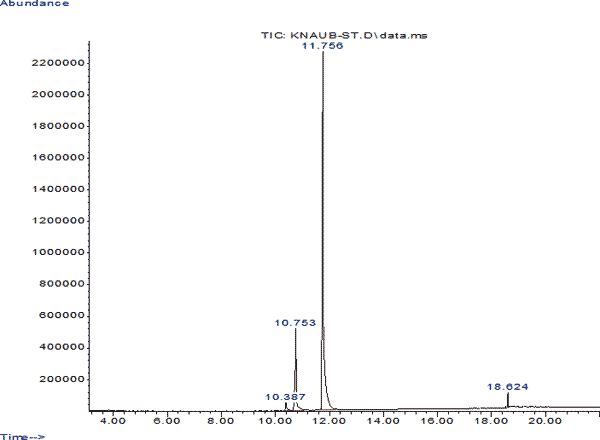
Рис. 1. Идентификация тропикамида методом ГЖХ с МС детектором
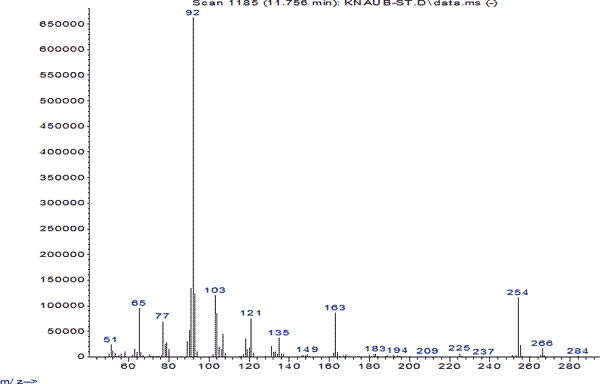
Рис. 2. Масс-спектр тропикамида при исследовании методом ГЖХ – МС
ВЭЖХ исследование: Раствор тропикамида с концентрацией 100 мкг\мл исследовали на жидкостном хроматографе марки «Миллхром – А-02» на колонке размером 2х75 мм, с обращенной фазой «Prontosil 120-5-С18), зернением 5 мкм. Детектирование проводили при 200, 220, 250, 300 нм. В качестве подвижной фазы использовали: элюент «А» – раствор кислоты трифторуксусной (ТФУ) 0,1%, элюент «Б» – ацетонитрил 100%. Градиент от 5 до 50% при скорости потока 150 мкл/мин и температуре колонки 35 °С. В этих условиях тропикамид выходит из колонки через 7,2 минут, о чем свидетельствует пик на хроматограмме и характерный для данного вещества спектр (рис. 3).
Количественное определение тропикамида проводилось методом ВЭЖХ по калибровочному графику, построенному с использованием спиртовых растворов тропикамида концентраций 50, 100, 200 мкг/мл.
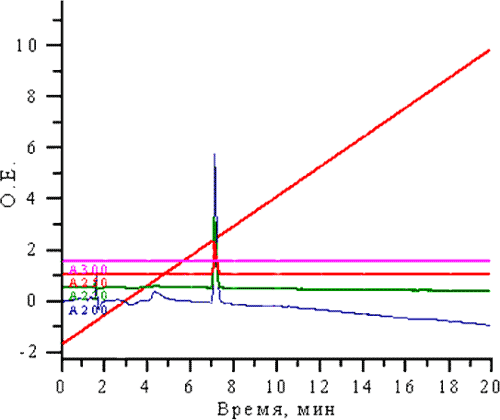
Рис. 3. Определение тропикамида методом ВЭЖХ (хроматограмма)
Влияние рН среды на степень извлечения тропикамида органическими растворителями. Для изучения влияния рН среды на степень извлечения тропикамида использовали буферные растворы со значением рН от 2 до 11,2. Буферные растворы готовили из универсальной буферной смеси, содержащей кислоту борную – 2,47г, кислоту о-фосфорную – 2,4 мл, кислоту уксусную – 2,27мл в 1 литре воды очищенной. Для получения буфера с определенным значением рН к 100 мл этой смеси добавляли различный объем раствора 0,2н гидроксида натрия. В результате проведенных экспериментов сделали вывод, что максимальное извлечение тропикамида достигается при рН водной фазы 7,9, что теоретически вполне обосновано (рКа-5,2) .
Выбор экстрагента: Для проведения исследования по выбору оптимального экстрагента использовали диэтиловый эфир, н-гексан и хлороформ (табл.3).
Таблица 3 Зависимость выхода тропикамида от характера экстрагента
| Экстрагент | Оптическая плотность | |||||
| Х1 | Х2 | Х3 | X±ΔХ | SX | E | |
| Диэтиловый эфир | 0,448 | 0,442 | 0,446 | 0,445±0,007 | 0,002 | 1,7 |
| Хлороформ | 0,589 | 0,606 | 0,603 | 0,602±0,010 | 0,002 | 1,67 |
| Гексан | 0,016 | 0,022 | 0,015 | 0,018±0,009 | 0,002 | 53,2 |
Из таблицы следует, что лучшим органическим растворителем для извлечения тропикамида методом жидкость-жидкостной экстракции является хлороформ. Удовлетворительные результаты были получены и при использовании диэтилового эфира. Использование гексана нецелесообразно, ввиду его низкой экстракционной способности.
Изолирование: На модельном эксперименте сделан выбор оптимального метода изолирования тропикамида из биологического материала. Отравления тропикамидом зачастую происходят в сочетании с другими веществами (в том числе с алкалоидами опия), поэтому мы использовали методы изолирования, наиболее часто применяемые в судебно-химической практике. Выход тропикамида при изолировании подкисленной водой (Швайкова М.Д., 1975) в среднем составил 26,4%, изолирование нейтральным ацетоном (Карташов В.А. и соавт.1988) до 60% и методом кислотного гидролиза, применяемого для изолирования алкалоидов опия, лишь 18%. Однако, этот метод дает возможность использования его в случае комбинированных отравлений с алкалоидами опия.
Оптимальным элюентом при ТСХ для тропикамида является 0,1 н. раствор соляной кислоты и спирт этиловый 96%. Использование этих растворителей позволяет элюировать тропикамид до 69,8 и 86,8% соответственно.
Разработанный нами химико-токсикологический метод был апробирован на лабораторных животных. Белым крысам вводили по 5мл 1% раствора тропикамида внутрибрюшинно. У животных брали на анализ органы: стенку желудка, печень и почки, мочу. У первой крысы органы исследовали спустя 2 часа после инъекции, а у второй – спустя сутки.
Изолирование тропикамида и его метаболитов из тканей внутренних органов проводили ацетоновым методом по В.А. Карташову. Выделение тропикамида из мочи производили методом жидкость-жидкостной экстракции при рН=8 и методом кислотного гидролиза по методике для определения опиатов. При исследовании извлечений методом ТСХ тропикамид был обнаружен во всех внутренних органах крыс, кроме почек второго животного, и моче. Возможные метаболиты были обнаружены только в стенке желудка второго животного и в моче после кислотного гидролиза. Исследование методом ВЭЖХ подтвердило наличие тропикамида в органах лабораторных животных (кроме почки крысы №2). Результаты ВЭЖХ исследования представлены на рис. 4.
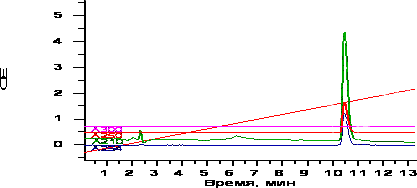
Рис. 4 Исследование тропикамида методом ВЭЖХ (стенка желудка первой крысы)
Количественное содержание тропикамида в различных органах устанавливали методом ВЭЖХ по методике, описанной ранее. Результаты представлены в табл. 4.
Таблица 4 Содержание тропикамида в органах лабораторных животных
| Орган | Содержание тропикамида, мг% |
| Стенка желудка крысы №1 | 94,3 |
| Стенка желудка крысы №2 | 3,3 |
| Печень крысы №1 | 16,9 |
| Печень крысы №2 | 0,73 |
| Почка крысы №1 | 21,9 |
| Почка крысы №2 | - |
Проведенные эксперименты с лабораторными животными подтверждают эффективность предложенной нами схемы химико-токсикологического анализа, и эти данные могут быть использованы в практике химических отделений бюро СМЭ.
Выводы: Показана возможность использования ТСХ, СФМ, ВЭЖХ и ГЖХ-СМ методов для исследования тропикамида в биоматериале. Тропикамид имеет максимумы поглощения при длинах волн 212, 258 нм (в щелочной среде), 204, 255 нм (в кислой среде), 203, 258 (в нейтральной среде). Установлены оптимальные условия для экстракции тропикамида. Для изолирования тропикамида из биологических объектов целесообразно использование ацетонового метода по В.А. Карташову.
Список литературы
- Аляутдин Р.Н. и др. /Фармакология / – М.: Издательство: ГЭОТАР-Медиа, 2007. – 592с.
- Карташов В.А., Кнауб В.А., Чернова Л.В. /Извлечение азотсодержащих органических оснований из ткани печени / ж. Судеб.-мед. экспертиза, -1988. - №4. –С. 31-33.
- Швайкова М.Д., /Токсикологическая химия / - М. – 1975. - 376с.

