Вы здесь
Определение флуоксетина в биологических объектах
Publication in electronic media: 08.08.2010 under http://journal.forens-lit.ru/node/186
Publication in print media: Актуальные вопросы судебной медицины и экспертной практики, Новосибирск 2009 Вып. 15
Н. Н. Кнауб, В. А. Кнауб, Д. Д. Даутова
г. Барнаул
Флуоксетин (Прозак, Профлузак, Флоксэт, Флувал и др.) является селективным ингибитором обратного захвата серотонина, широко используется для лечения депрессий различной этиологии (Пантелеева Г. П., 2000, Hyttel J., 1990).
Флуоксетин, как и другие антидепрессанты этой группы, обладает побочными эффектами, которые проявляются развитием желудочно-кишечных расстройств, появлением психомоторного возбуждения, усилением суицидальных тенденций, маниакальными вспышками, нарушением сознания от делирия до сопора и комы с последующим летальным исходом (Пантелеева Г.П., 2002).
Флуоксетин — (±)-N-метил-3-фенил-3-(пара-трифторметил) феноксипропиламина гидрохлорид, представляет собой белый кристаллический порошок, хорошо растворимый в метаноле, этаноле, ацетонитриле, хлороформе и ацетоне, растворимый в этилацетате, дихлорэтане, воде (14 г/л), нерастворимый в толуоле, циклогексане, гексане.
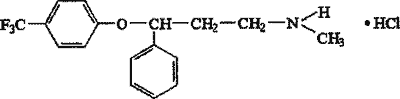
В литературе описаны смертельные случаи отравления флуоксетином в комбинации с алкоголем, мапротилином; кодеином, темазепамом (Пантелеева Г. П., 2002, Kincaid R. L., 1990). Однако в судебно-химическом отношении флуоксетин изучен недостаточно. В связи с этим разработка методик определения данного препарата в биологических объектах является весьма актуальной.
Целью нашего исследования является изучение возможности определения флуоксетина в биологических объектах.
Материалы и методы исследования
Исследование проводили на модельных образцах ткани печени и на экспериментальных лабораторных животных. Изолирование флуоксетина из биологических объектов осуществляли нейтральным ацетоном по методу, разработанному В.А. Карташовым (1988).
Для идентификации флуоксетина, выделенного из биологического материала, применяли метод газожидкостной хроматографии с масс-сел ективным детектированием (ГЖХ МС). Определение проводили с помощью газового хроматографа Angilent Technologies 6890N Network GC System с масс-селективным детектором модели 5973 в режиме ионизации электронным ударом (70 эВ), с автоматическим жидкостным дозатором модели 7683 В Series. Хроматографический анализ осуществляли при следующих условиях: колонка — кварцевая капиллярная НР-5MS (30 м х 0,252 мм, толщина пленки фазы — 0,25 мкм); температура инжектора 280°С, интерфейс детектора — 310°С; начальная и конечная температура термостата колонки — 50 и 280°С соответственно, температура термостата колонки изменялась со скоростью 10 град/мин; газ-носитель — гелий; деление потока 1:40; объем вводимой пробы — 1 мкл. В качестве стандартного образца использовали спиртовый раствор флуоксетина 100 мг/мл и 10 мг/мл.
Регистрацию масс-спектров проводили в режиме по полному ионному току. Полученные масс-спектры сравнивали с библиотечной базой данных. Анализировали идентифицированные пики веществ с процентом вероятности не менее 70.
Количественное определение флуоксетина также проводили га-зохроматографическим методом. Для этого использовали хроматограф «Кристалл 5000.1» с детектором по ионизации пламени. Условия хроматографирования: колонка кварцевая капиллярная HP-5MS (30 м х 0,25 мм, толщина пленки фазы — 0,25 мкм); температура инжектора 290°С, детектора — 290°С; температура колонки 120°С с дальнейшим повышением до 260°С со скоростью 15°С за 1 мин; газ-носитель — гелий; деление потока 1:40; объем вводимой пробы — 1 мкл.
Для построения калибровочного графика использовали спиртовые растворы флуоксетина 50, 100 и 150 мкг/мл. Уравнение регрессии рассчитывали методом наименьших квадратов. Метрологические характеристики метода количественного определения приведены в таблице 1.
Таблица 1
Количественное определение флуоксетина методом ГЖХ
| Концентрация (мкг/мл) | Высота пика х±Δх (%) | Стандартное отклонение среднего (Sx) |
| 50 | 57,4 ±14,21 | 3,3 |
| 100 | 119,2 ±12,7 | 3,3 |
| 150 | 162,6 ±24,28 | 5,7 |
Полученные результаты позволили получить уравнение регрессии следующего вида: Y = 1.056 *Х + 7.22, коэффициент корреляции составил 0,986.
Результаты исследования и их обсуждение
Газохроматографическое определение флуоксетина проводили после изолирования его из биологического материала нейтральным ацетоном. Эксперимент проводили на модельных образцах ткани печени. В результате проведенных исследований было установлено, что в среднем из ткани печени нейтральным ацетоном извлекается около 31% флуоксетина.
Разработанные методики определения флуоксетина в биологических объектах были апробированы в эксперименте на лабораторном животном (крыса). Белой лабораторной крысе перорально вводили водную суспензию флуоксетина из расчета 0,6 мг на г массы животного. Изолирование флуоксетина из внутренних органов (стенка желудка, печень, почка) проводили нейтральным ацетоном.
Идентифицировали флуоксетин в полученных извлечениях методом ГЖХ МС в условиях, описанных ранее. Результаты идентификации представлены на рис. 1,2.
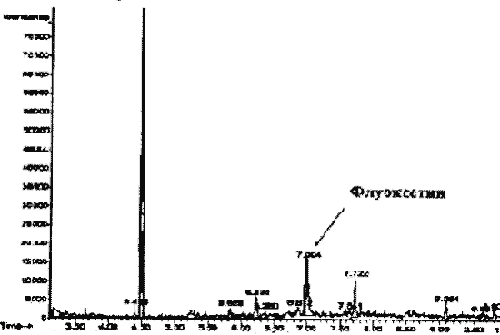
Рис. 1 Результаты идентификации флуоксетина методом ГЖХ-МС
Как видно из представленной хроматограммы, время удерживания флуоксетина составило 7,004 мин. Полученный масс-спектр вещества, выделенного из биологического материала, полностью идентичен масс-спектру флуоксетина (по данным электронной библиотеки масс-спектров).
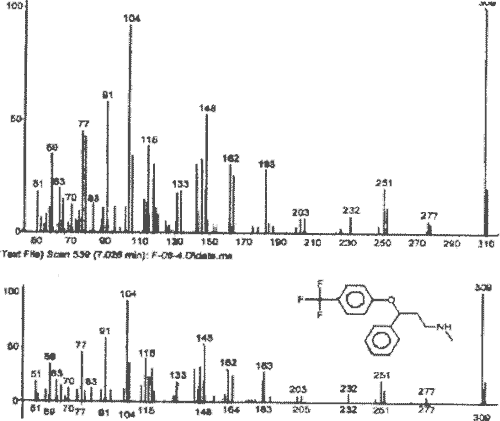
Рис. 2 Масс-спектр флуоксетина
Результаты количественного определения флуоксетина, изолированного из внутренних органов экспериментального животного, нейтральным ацетоном приведены в таблице 2.
Таблица 2
Содержание флуоксетина во внутренних органах экспериментального животного
| Орган | Печень | Почки | Стенка желудка |
| Концентрация, мг% | 12,1 | 8,8 | 22,5 |
Из представленных данных следует, что максимальное количество флуоксетина обнаружено в стенке желудка и составило 22,5 мг%, минимальное количество — в почках — 8,8 мг%.
Выводы
- Разработан газохроматографический метод идентификации и количественного определения флуоксетина.
- Применен метод изолирования нейтральным ацетоном для выделения флуоксетина из биологического материала. Выход составил около 31%.
- Проведена апробация изученных методик изолирования и определения флуоксетина на экспериментальном животном.

