Вы здесь
Изолирование, идентификация и количественное определение эналаприла в биоматериале
Publication in electronic media: 21.06.2010 under http://journal.forens-lit.ru/node/173
Publication in print media: Актуальные вопросы судебной медицины и экспертной практики, Новосибирск 2009 Вып. 15
Л. Г. Воронкова, Л, Е. Кудрикова, А. Н. Рыженков
г. Барнаул
Эналаприл — гипотензивное средство, является очень востребованным препаратом. По данным Интернет-ресурса «Большой город» он входит в десятку самых покупаемых лекарственных средств в России.
В литературных источниках отсутствуют данные о смертельных отравлениях эналаприлом. Однако, в 2008 г. в практике работы токсикологической лаборатории было 8 несмертельных случаев отравления эналаприлом, а в 2007 г. — 1 смертельное отравление в сочетании со снотворными.
Целью нашего исследования является изучение свойств препарата эналаприл и разработка частной методики химико-токсикологического анализа.
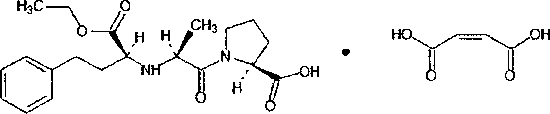
Эналаприл применяется в виде соли малеиновой кислоты, МНН:
Эналаприла малеат, Химическое название: 1-[N-(S)-1-Kapбoкси-3-фенилпропил]-L-аланил-L-пролин-1' этиловый эфир.
Предварительно нами было установлено, что в коротковолновой области спектра эналаприл не имеет четко выраженного максимума, лишь наблюдается перегиб спектральной кривой при длине волны 200 — 210 нм, где интенсивно поглощают примеси. Поглощение в максимуме при λ=260 нм невысокое, поэтому предел обнаружения препарата низкий. Следовательно, методом УФ-спектрофотометрии эналаприл исследовать нецелесообразно.
В настоящее время для идентификации и количественного определения веществ широко используется метод высокоэффективной жидкостной хроматографии (ВЭЖХ), благодаря высокой специфичности и чувствительности. Исследование водно-спиртового раствора эналаприла проводили с помощью хроматографа серии «Милихром-А-02», в градиентном режиме. Колонка Нуклеосил-С-18 2x75 мм, d=5 мкм. Элюент А — 0,01% раствор трифторуксусной кислоты, элюент В — ацетонитрил — 0,1% раствор трифторуксусной кислоты (9:1), концентрация элюента В менялась от 30 до 90% за 10 минут. Скорость подачи элюента 100 мкл/мин, температура колонки 35°С.
На хроматограмме наблюдали 2 пика, первый пик соответствует малеиновой кислоте, второй — эналаприлу.
Параметры удерживания и спектральные отношения препарата эналаприла малеата приведены в таблице 1.
Таблица 1
Параметры удерживания и спектральные отношения эналаприла и малеиновой кислоты
| Вещество | Время удерживания, мин | Объем удерживания, мкл | Спектральные отношения | |
| D254/D210 | D300/D210 | |||
| Эналаприл | 5,7 | 565 | 0,0 | 0,0 |
| Малеиновая кислота | 2,6 | 256 | 0,1 | 0,0 |
Таким образом, метод ВЭЖХ позволяет надежно идентифицировать эналаприл по параметрам удерживания и спектральным отношениям. Количественное определение проводится по высоте или площади пика. Чувствительность методики для эналаприла составила 1 мкг/мл. Поэтому ВЭЖХ нами выбран как основной метод идентификации и количественного определения препарата.
В качестве дополнительного метода применяли тонкослойную хроматографию. Наиболее чувствительным способом обнаружения эналаприла в методе ТСХ является последовательная обработка хроматограмм раствором сульфата ртути (II) и раствором дифенилкарбазона в хлороформе, при этом наблюдались сиреневые пятна. Были подобраны две системы растворителей: ацетон-муравьиная кислота (20:1), (значение Rf 0,79±0,05) и хлороформ-ацетон-муравьиная кислота (10:2:2), (значение Rf 0,54±0,1).
Для разработки метода изолирования эналаприла необходимо изучить его способность экстрагироваться из водных растворов. Количество извлеченного препарата определяли методом ВЭЖХ. Графики зависимости степени экстракции (R%) эналаприла из водных растворов различными растворителями при различных значениях рН представлены на рисунке 1.

Рис. 1. Зависимость степени экстракции эналаприла из водных растворов от рН среды
Степень экстракции препарата хлороформом и эфиром зависит от рН, максимальная степень экстракции наблюдается при рН 4,44, однако для эфира составляет 18,03%, а для хлороформа 98,69%. Степень экстракции гексаном незначительна и от рН не зависит.
С учетом полученных данных разработана схема химико-токсикологического анализа препарата эналаприл. За основу был взят метод изолирования с помощью нейтрального ацетона, разработанный В.А. Карташовым с соавт. (1988). В методику были внесены некоторые модификации: на этапе очистки вместо 20 мл 0,5 н. соляной кислоты брали 10 мл; на конечном этапе изолирования вместо эфира использовали хлороформ; высаливающий агент — натрия хлорид добавляли на этапе экстракции из кислого раствора (в оригинальной методике его добавляют при экстракции веществ основного характера). В этом случае выход вещества в модельном эксперименте составил 71%. Схема исследования биологического материала представлена на рисунке 2.

Рис. 2. Схема химико-токсикологического анализа препарата эналаприл
Эффективность разработанной методики была доказана в остром опыте на лабораторных животных крысах. На анализ брали внутренние органы (печень, почки, стенка желудка), а также содержимое желудка. При исследовании во всех органах был обнаружен эналаприл и его метаболиты. Данные по количественному содержанию эналаприла представлены в таблице 2.
Таблица 2
Результаты количественного определения содержания эналаприла в органах животных
| Исследуемый объект | Содержимое желудка | Стенка желудка | Печень | Почки |
| Масса объекта, в граммах | 1,2 | 1,1 | 8,5 | 1,7 |
| Площадь пика (AU*мкл) | 9,4 | 1,4 | 0,2 | 2,1 |
| Концентрация эналаприла, в мг% | 1326,2 | 198,5 | 4,9 | 198,3 |
Как следует из таблицы, максимальная концентрация эналаприла обнаружена в содержимом желудка и соответствует 1326,16 мг%, это говорит о том, что препарат на момент гибели животного всосался не полностью. Минимальная же концентрация обнаружена в печени и соответствует 4,87мг%, что говорит о том, что скорость биотрансформации эналаприла достаточно высокая.
Во всех биологических объектах обнаружены метаболиты, причем наибольшее их количество найдено в печени и почках, меньше в стенке желудка и его содержимом.
Таким образом, эналаприл изолируется из биоматериала нейтральным ацетоном, с последующим высаливанием и экстракцией хлороформом. Выход вещества составляет около 70%. Для идентификации эналаприла можно применять ТСХ и ВЭЖХ.

