Вы здесь
Изолирование тианептина из биологических объектов при судебно-химическом исследовании
Publication in electronic media: 21.06.2010 under http://journal.forens-lit.ru/node/174
Publication in print media: Актуальные вопросы судебной медицины и экспертной практики, Новосибирск 2009 Вып. 15
Н. Н. Кнауб, Л. Е. Кудрикова, О. П. Бирюков
г. Барнаул
Тианептин (Coaxil, Stablon и др.) - трициклический антидепрессант, оказывающий тимоаналептическое и анксиолитическое действие, применяется для лечения депрессий различной этиологии. Механизм действия препарата связывают с повышением обратного захвата серотонина нейронами коры головного мозга и гиппокампа. Употребление препарата улучшает настроение, устраняет двигательную заторможенность, повышает общий тонус организма, нормализует поведение больных алкоголизмом в период абстиненции, в терапевтических дозах не вызывает привыкания.
С декабря 2006 года препарат поставлен на предметно-количественный учет и в аптеках отпускается только по рецептам врача. Причиной этому явилось применение тианептина в качестве одурманивающего средства наркозависимыми людьми. Взрослому человеку для достижения состояния эйфории необходима доза около 250-375 мг (около 20-30 таблеток). Известны случаи смертельных отравлений тианептином при передозировке (Дюкова Г., 1997, Литвинов Э., 1998)
По химической структуре тианептин является производным ди-бензотиазепина (7-[(3-хлоро-6,1] дигидро-5,5-диоксо-6-метилдибензо-[c,f][1,2] тиазепин 11-у1) амино] гептановая кислота).
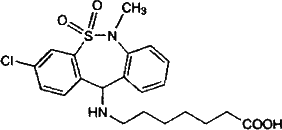
Препарат имеет в структуре третичный, вторичный атомы азота, карбоксильную группу и обладает амфотерными свойствами. Это обстоятельство создает определенные трудности при изолировании тианептина из биологических объектов.
Методы химико-токсикологического анализа тиопентина недостаточно изучены и нуждаются в дополнительной разработке.
Целью настоящей работы явилось изучение условий экстракции тианептина из биологических объектов.
Материалы и методы исследования
Изучение условий извлечения тианептина из водных растворов проводили, используя универсальные буферные растворы со значением рН среды от 2 до 10 (Лурье Ю. Ю., 1979).
Качественное и количественное определение тианептина осуществляли на жидкостном микроколоночном хроматографе марки «Милихром-А-02». Условия хроматографического анализа: колонка размером 2x75 мм, с обращенно — фазовым сорбентом Silasorb SPH 5С18, зернением 5 мкм. Детектирование проводили при 200, 220, 270, 300 нм. В качестве подвижной фазы использовали: элюент А — раствор кислоты трифторуксусной (ТФУ) 0,1%, элюент Б — ацетонитрил 100%. Хроматографирование проводили при использовании градиента концентраций от 10% до 80% ацетонитрила при скорости потока 150 мкл/мин и температуре колонки 35°С. Продолжительность анализа 10 мин.
Результаты исследования и их обсуждение
Для разработки условий качественного и количественного анализа тианептина методом ВЭЖХ использовали спиртовой раствор тианептина с концентрацией действующего вещества 200 мкг/мл. Анализ проводили методом ВЭЖХ при условиях, описанных ранее. Идентификацию тианептина проводили по времени удерживания, объему удерживания, спектру абсорбции и спектральным отношениям относительно базовой длины волны 200 нм. Данные хроматографического анализа представлены на рис. 1.
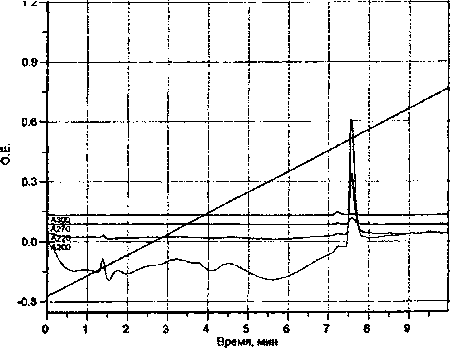
Рис. 1 Определение тианептина методом ВЭЖХ
Как видно из приведенной хроматограммы, время удерживания тианептина составило 7 мин 42 сек. Анализ спектральной кривой показал, что тианептин имеет выраженный максимум абсорбции при 205 нм и плато в диапазоне длин волн от 225-230 нм и 265-275 нм (рис. 2).
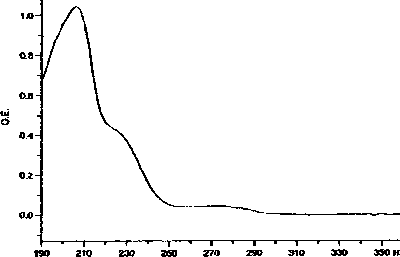
Рис. 2 Спектр абсорбции тианептина
Параметры удерживания, спектральные отношения тианептина представлены в таблице 1.
Таблица 1
Параметры удерживания и спектральные отношения для тианептина
| Время удерживания (мин) | Объем удерживания (мкл) | Спектральные отношения (относительно 200 нм) | ||
| 220/200 | 270/200 | 300/200 | ||
| 7,4 | 1134,3 | 0,5 | 0,0 | 0,0 |
Изучение влияния рН среды на степень извлечения тианептина в органический растворитель проводили с использованием универсальной буферной смеси. Для этого к буферному раствору с заданным зна-чением рН среды (от 1 до 10) добавляли раствор тианептина. В качестве экстрагента использовали диэтиловый эфир. Пробы встряхивали, центрифугировали, количественно отделяли фазу органического растворителя. Диэтиловый эфир испаряли на водяной бане при нагревании, сухой остаток растворяли в спирте этиловом 95% и исследовали далее. Полученные данные исследований представлены на рис. 3.
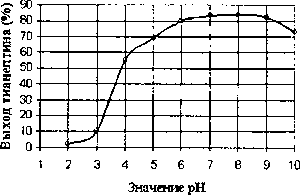
Рис. 3 Зависимость экстракции тианептина в эфир от значения рН среды водной фазы
Результаты проведенного эксперимента свидетельствуют о том, что оптимальное значение рН среды для извлечения тианептина в органический растворитель из водной фазы находится в пределах 6 — 9. При экстракции вещества из кислой среды (рН 2—3) степень извлечения резко уменьшается. Увеличение рН среды до 10 и более также приводит к снижению выхода тианептина.
Полученные данные брали во внимание при изучении вопросов изолирования тианептина из биологических объектов общими методами (по Васильевой и по Карташову). Исследование проводили на модельных образцах ткани печени по методикам, описанным в литературе (Карташов В. А., 1988, Швайкова М. Д., 1975).
Учитывая амфотерный характер тианептина, исследовали извлечение из кислой и щелочной среды.
Количественное определение проводили методом ВЭЖХ в условиях описанных ранее. На хроматограммах полученных в результате исследования наблюдали пик с параметрами удерживания и спектральными отношениями соответствующими тианептину. Расчет количественного содержания проводили по стандарту. Результаты обрабатывали относительно площади пика тианептина, соответствующего 200 мкг (100%) (табл. 2)
Таблица 2
Количество тианептина, извлеченного из биологического материала по методу Васильевой и Карташова
| Метод | Кислое извлечение | Щелочное извлечение |
| х±Δх (%) | х±Δх (%) | |
| Васильевой | 15,4±3,5 | 11,5±0,4 |
| Карташова | 13,2±5,9 | 24,0±3,4 |
Как видно из данных, представленных в таблице 2, тианептин присутствует как в кислом, так и в щелочном извлечениях. Учитывая полученные результаты, необходимо отметить, что при использовании общих методов изолирования для извлечения тианептина, целесообразно объединять кислые и щелочные извлечения. В этом случае метод Карташова предпочтительнее метода Васильевой, так как дает более высокий суммарный выход (около 37%).
Выводы
- Изучено влияние рН среды и природы органического растворителя на экстракцию тианептина из водных растворов.
- Разработаны условия идентификации и количественного определения тианептина методом ВЭЖХ.
- Показана возможность использования некоторых общих методов изолирования для выделения тианептина из биологических объектов.
- Проведена сравнительная оценка эффективности общих методов изолирования по Васильевой и Карташову применительно к тианептину.

