Вы здесь
Применение метода ионной хроматографии при отравлениях минеральными неорганическими кислотами
Publication in electronic media: 21.12.2011 under http://journal.forens-lit.ru/node/603
Publication in print media: Актуальные вопросы теории и практики судебно-медицинской экспертизы, Красноярск 2007 Вып. 5
Т. С. Кандыба, О. А. Дукова, О. П. Калякина
КГУЗ "ККБСМЭ", г. Красноярск
Разработана методика ионхроматографического определения минеральных кислот в стенке желудка в виде соответствующих анионов. Проведено сравнение результатов исследования 30 образцов стенки желудка. Установлен качественный и количественный естественный (фоновый) ионный состав. Степень извлечения соответствующих анионов кислот при пробоподготовке в условиях данной лаборатории для стенки желудка составляет - 65%. Методика предназначена для токсикологических анализов и апробирована при проведении судебно-химических исследований при отравлениях кислотами.
В практике судебно-химического исследования при подозрении на отравление кислотами и их солями исключают: серную кислоту, азотную кислоту, хлористоводородную кислоту, нитриты и нитраты солей щелочных металлов и аммония.
Минеральные кислоты имеют очень широкое применение в различных областях промышленности и в быту. Встречаются, как случайные, так и умышленные отравления.
Смертельной дозой при приемах внутрь являются:
- Для H2S04- 5 мл
- Для HN03 - 8 мл
- Для HCI около 15 мл
- Для N03- 5 - 9 г
Отравления минеральными кислотами относятся к производственным отравлениям и чаще всего связаны с несоблюдением техники безопасности. Однако известны криминальные случаи обливания кислотами, что приводит к судебно-химическому исследованию одежды, белья и пятен на них.
Типичная схема судебно-химического исследования при подозрении на отравления кислотами включает множество стадий пробоподготовки, которая занимает более 2 суток. Непосредственно химический анализ с учетом применяемых методик и классических химических методов исследования отличается большой трудоемкостью, низкой селективностью и специфичностью. А в случаях перехода свободных кислот в их соли, обнаружение вообще делается невозможным, т.к. последние являются составными частями организма.
Это побудило нас усовершенствовать методику пробоподготовки и внедрить метод ионной хроматографии для судебно-химических исследований при отравлениях кислотами.
Ионная хроматография на сегодняшний день является в мире арбитражным методом анализа при исследовании состава неорганических анионов водных растворов. Обладая поистине фантастической производительностью (небольшое время анализа), метод обладает минимальной инструментальной погрешностью и высокой воспроизводимостью результатов.
Особенности метода ионной хроматографии:
- возможность определения требуемых ионов за один анализ в пробах с мешающими ионами и/или органическими соединениями;
- универсальность - определение катионов и анионов (в том числе органических);
- широкий выбор проверенных методик по различным областям применения от экологического контроля до анализа напитков и технических продуктов.
Преимущества метода:
- низкий предел обнаружения метода с химическим подавлением фона до 2-4 мкг/л (для анионов);
- широкий линейный диапазон определения с электронным подавлением фона 5-25000 мкг/л (для хлорид-аниона);
- минимальная величина пробы 200-500 мкл;
- возможность автоматизации всех стадий процесса от пробоподготовки до детектирования;
- относительно высокая производительность при использования автосамплера. Ограничения метода:
- ограниченно используется для анализа органических соединений;
- ограниченно используется для анализа металлов;
- ограниченно используется для анализа полимеров;
- не используется для анализа газов [1 ].
Теоретические основы метода ионной хроматографии
Ионная хроматография - метод разделения органических и неорганических ионов, высокоэффективный вариант ионообменной хроматографии с применением кондуктомет-рического детектирования разделенных ионов [2]. В основе метода ионной хроматографии лежит процесс ионного обмена между ионообменником и анализируемым раствором.
Ионный обмен заключается в том, что некоторые вещества (ионообменники) при погружении в раствор электролита поглощают из него катионы или анионы, выделяя в раствор эквивалентное число других ионов с зарядом того же знака [3].
Разделение анионов производится на анионообменниках, содержащих фиксированные группы -NR3, -NHR2, -NH2R и анионы как противоионы. Наиболее распространенными элюентами при определении анионов являются (1-5)'10~3 М растворы карбоната, гидрокарбоната или гидроксида натрия [4].
Время и порядок элюирования анионов определяется их зарядом и размером гидратированного иона. Ионы удерживаются тем сильнее, чем больше их заряд и размер гидратированного иона. Элюирующая способность подвижной фазы возрастает с увеличением концентрации ионов, содержащихся в ней, и их сродства к ионообменнику [5].
Результатом ионхроматографического исследования является хроматограмма - график зависимости электропроводности исследуемого раствора от времени анализа, т.е. каждый пик на хроматограмме [6].
Таким образом, с помощью метода ионной хроматографии можно определить ионный состав практически любого жидкого объекта [7].
Материалы и методы исследования
Реактивы, приборы и методика эксперимента
В работе использовали следующие реактивы:
- Na2C03, ч. д. а.;
- NaHC-О3, ч. д. а.;
- NaF, ч. д. а.;
- NaCl, ч. д. а.;
- NaN02, ч. д. а.;
- KN03, ч. д. а.;
- Na2S04, ч. д. а.;
- Na3P04, ч. д. а.;
- бидистиллированная вода.
В работе использовали следующие приборы и посуду:
- ионный хроматограф «Цвет-3006» с кондуктометрическим детектором: петля-дозатор 30 мкл, предварительная колонка 200x6 - смешанный слой сорбента КУ-2 и АВ-17 с зернением 100-200 мкм и емкостью 2 мгэкв/л, разделительная колонка 120х5 -сорбент КанК-АСт с зернением 14 мкм и емкостью 0,01 мгэкв/л, подавительная колонка 200x6 - сорбент КУ-2 с зернением 100-200 мкм и емкостью 1 мгэкв/л;
- шприц медицинский;
- мерные колбы и цилиндры;
- центрифуга;
Перед началом работы готовили концентрированный раствор элюента: 60 ммоль NaHC-O3 и 50 ммоль Na2C03. Затем готовили рабочий раствор элюента: 25 мл концентрированного раствора элюента помещали в колбу на 500 мл и доводили до метки бидистиллированной водой. Рабочий раствор готовили каждый день, так как он устойчив одни сутки.
Стандартные смеси анионов готовили путем разбавления индивидуальных растворов анионов с концентрацией 1 г/л. Используемый стандартный раствор шестикомпонентной смеси ионов содержал фторид-иона - 2 мг/л, хлорид-иона - 10 мг/л, нитрит-иона -15 мг/л, нитрат-иона - 20 мг/л, сульфат-иона - 20 мг/л, фосфат-иона - 25 мг/л.
Ионный хроматограф прогревали 20 минут каждый раз после включения, в то же время пропускали элюент для кондиционирования колонки. Скорость потока элюента 1,5 мл/мин.
Анализируемый раствор вводили в петлю-дозатор с помощью медицинского шприца и сразу же запускали программу записи хроматограммы. После окончания анализа фиксировали полученные хроматограммы, обрабатывали их и редактировали. Проводили три параллели опыта.
Методика пробоподготовки стенки желудка
20 г измельченной стенки желудка заливали 80 мл бидистиллированной водой, через 24 часа смесь фильтровали. Далее исследовали полученную водную вытяжку (диализат).
Концентрацию анионов кислот рассчитывали с использованием стандартных растворов шестикомпонентной смеси анионов. За количественную характеристику брали площади соответсвтующих пиков. Площадь пиков и время удерживания определяли с помощью программы Chromatograf, а редактирование хроматограмм проводили с помощью программы Origin 5.0. Хроматографические параметры стандартной шестикомпонентной смеси анионов представлены в таблице 1.
Таблица 1 Хроматографические параметры стандартной шестикомпонентной смеси анионов
| Ион | Концентрация, мг/л | Время удерживания, с | Потенциал, мВ |
| F- | 5 | 237,297 | 85,7565 |
| Сl- | 10 | 315,952 | 50,2765 |
| N02- | 20 | 363,944 | 19,0925 |
| НРО- | 25 | 465,262 | 9,7055 |
| N03- | 50 | 573,246 | 38,1845 |
| S042- | 50 | 791,879 | 47,412 |
Определение концентрации ионов в исследуемой пробе проводили методом стандартов по формуле 1.
где Сх - концентрация компонента в анализируемой пробе, Сст - концентрация этого же компонента в стандартном растворе, hx - высота пика компонента на хроматограмме пробы, hCT - высота пика этого же компонента на хроматограмме стандартного раствора, к - коэффициент пересчета (для стенки желудка к = 0,65).
Для определения степени извлечения по данной методике в условиях лаборатории к контрольным образцам стенки желудка добавляли водные растворы анионов кислот известной концентрации.
Для определения естественного (фонового) ионного состава холостой стенки желудка исследование проводили в условиях методики.
Результаты исследования и их обсуждение
Полученные хроматограммы стандартной шестикомпонентной смеси анионов, холостой стенки желудка и стенки желудка с затравкой различными кислотами приведены на рисунках 1-6.
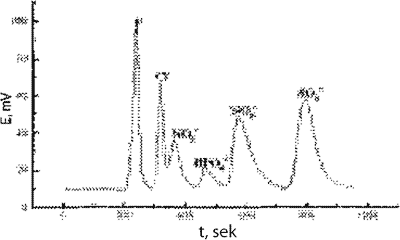
Рис. 1. Хроматограмма стандартной шестикомпонентной смеси анионов желудка.
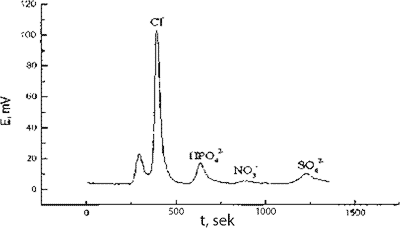
Рис. 2. Хроматограмма диализата холостой стенки

Рис. 3. Хроматограмма диализата затравки стенки желудка серной кислотой.
Примечание: Для более наглядности используется наложение хроматограммы исследуемой пробы на хроматограммы стандартов (рис. 4).

Рис. 4. Хроматограмма диализата затравки стенки желудка серной кислотой с наложением на холостую пробу стенки желудка.
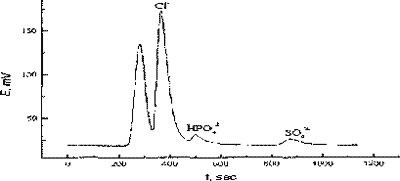
Рис. 5. Хроматограмма диализата затравки стенки желудка соляной кислотой.
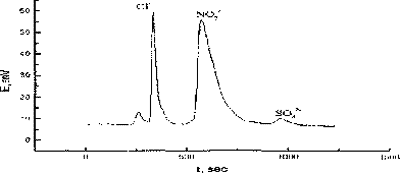
Рис. 6. Хроматотрамма диализата затравки стенки желудка нитратами и нитритами. Нитриты в биологических объектах окисляются до нитратов.
Количественно были проанализированы 30 проб холостой стенки желудка, в том числе с гнилостными изменениями. Установили качественный и количественный естественный (фоновый) ионный состав (Р=0,95, n=30) - таблица 2.
| Качественный фоновый ионный состав, (n=30) | Количественный ионный состав, мг в 100 г объекта |
| Хлорид - ион | 38,2±06 |
| Фосфат - ион | 9,5±0,3 |
| Сульфат - ион | 5,2±0,3 |
| Нитрат - ион | 0,5*0,1 |
Степень извлечения морфина в условиях данной лаборатории составила для стенки желудка - 65±3%.
Метод ионной хроматографии был апробирован и использован при судебно-химическом исследовании реального случая отравления серной (Рис. 7).
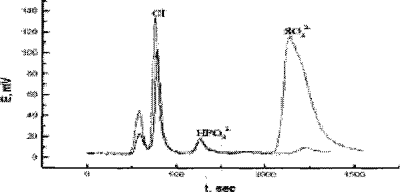
Рис. 7.
Таким образом, метод ионной хроматографии может применяться в судебно-химической экспертизе при отравлениях минеральными неорганическими кислотами и их солями. Исследованию можно подвергать не только органы, но и биологические жидкости, в частности кровь. Данный метод отвечает всем требованиям, предъявляемым современным к физико-химическим методам исследования.
Список литературы
- Современные методы анализа и оборудование в санитарно-гигиенических исследова-
ниях (научно-практическое руководство) / Под ред. проф. Онищенко Г.Г. и Шестопалова Н.В. -М: ФГУП «Интерсэн», 1999. - 496 с.
154 - Хроматография. Основные понятия. Терминология: Сборник научно-нормативной терминологии /'Отв. редактор С.А. Волков. -М.:Химия, 1997. - 48 с.
- Золотое, Ю.А. Основы аналитической химии. В 2 кн. Кн 1. Общие вопросы. Методы разделения: Учеб. для вузов /Ю.А. Золотое, Е.Н. Дорохова, В.И. Фадеева и др. Под ред. Ю.А. Зо-лотова. -М.: Высш. шк., 2002. - 351 с.
- Количественный анализ хроматографическими методами / Отв. ред. Э. Кац - М.: Мир, 1990. - 320 с.
- Шведт, Г. Хроматографические методы в неорганическом анализе /Г. Шведт. - М.: Мир, 1984. - 252 с.
- Фритц, Дж. С. Ионная хроматография /Дж, С. Фритц. -М.: Наука, 1984 - 315 с.
- Качин, С. В. Методы твердофазной спектроскопии и ионной хроматографии в анализе объектов окружающей среды / С. В. Качин, О. П. Калякина, Н. А. Козель, О. Н. Кононова, С. А. Сагалаков. - Красноярск: Краснояр. гос. ун-т, 2003 - 88 с.

