Вы здесь
Изолирование метформина из биологического материала и его идентификация
Publication in electronic media: 22.10.2011 under http://journal.forens-lit.ru/node/395
Publication in print media: Актуальные вопросы судебной медицины и права, Казань 2010 Вып. 1
ГКУЗ «Республиканское бюро судебно-медицинской экспертизы МЗ РТ»
В практике судебно-химического отделения имел место случай отравления препаратом «Сиофор» (действующее вещество – метформина гидрохлорид). Метформин (синонимы: Глиформин, Глюкофаг, Диформин, Diaberil, Diabetosan, Diabexil, Diformin, Diguanid, Glycoran, Melbin и др.) – N, N-диметилбигуанид:
(СН3)2 N - C NH - NH - C NH - NH2
представляет собой белый кристаллический порошок, легко растворимый в воде, растворимый в спирте, практически нерастворимый в хлороформе, эфире [1].
Метформин относится к синтетическим пероральным гипогликемическим (антидиабетическим) препаратам группы бигуанидов. Наибольший гипогликемический эффект наступает через 4-5 ч после применения препарата. Метформин применяют при лечении сахарного диабета 2 типа у взрослых в сочетании с инсулином при инсулинорезистентных формах диабета. Назначают внутрь во время или непосредственно после еды, начиная с 0,25-0,5 до 0,5-0,75 г 2-3 раза в день. Препараты группы гуанидинов (метформин, биформин, фенформин) были созданы и клинически использованы как пероральные гипогликемические средства в Европе в 1970 году. Однако, как отмечают зарубежные авторы, в 1977 году фенформин был запрещен к применению в Соединенных Штатах из-за его склонности вызывать серьезный молочный ацидоз.
Фармакокинетика. Метформин медленно всасывается после орального применения, практически не сязывается с белками крови. От 30 до 50% перо-ральной дозы его выводится с мочой в неизмененном виде в течение 24 часов и 30% в неизмененном виде с калом. Период полураспада метформина в среднем 6 часов. Биодоступность 50-60%. Отмечается, что после приема однократной пероральной дозы 500 мг пятерыми пациентами концентрация метформина в плазме их крови через 1-3 часа составила 1,0-2,3 мг/л. После приема однократной пероральной дозы 1500 мг у четверых из пяти пациентов концентрация метформина в плазме через 1,5 часа составила 3,1 мг/л. Максимальная концентрация в плазме не увеличивалась при длительном применении препарата, а концентрация в моче достигает 1600 мг/л [3].
Токсичность. В зарубежной литературе описаны 3 случая развития молочного ацидоза и вторичных почечных осложнений при длительном применении метформина, при этом концентрация метформина в плазме составила 45- 70 мг/л и пациентам назначали гемодиализ и форсированный диурез. После приема мужчиной 24 г метформина с суицидальной целью у него развился метаболический ацидоз, больной впал в кому (концентрация метформина в плазме составила 110 мг/л), смерть наступила через 40 часов.
В доступной нам литературе мы не встретили данных о методах изолирования метформина из биологического материала и его идентификации, поэтому судебно-химическое исследование проводилось экспериментальным путем.
Экспериментальная часть
- Изолирование метформина гидрохлорида из таблеток. 2 таблетки «Сиофор» по 500 мг измельчали в ступке, смешивали с водой, извлекали из кислой среды при рН=2 смесью хлороформ-эфир (2:1) и из щелочной среды при рН=9 хлороформом.
- Исследование биологического материала. Исходя из физико-химических свойств метформина, для изолирования были использованы два метода: а) подкисленной водой; б) подкисленным спиртом по Стассу-Отто.
Для идентификации выделенного метформина в биологическом материале использованы: хроматография в тонком слое сорбента, реакции окрашивания, спектрофотометрия в ультрафиолетовой области, высокоэффективная жидкостная хроматография. Из-за термолабильности метформина использование хромато-масс-спектрометрии и газовой хроматографии не представилось возможным.
Для хроматографии в тонком слое сорбента использованы хроматографические пластинки «Сорбфил-ПТСХ-П-А».
Таблица 1. Коэффициент распределения метформина в различных системах растворителей
| № пп. | Системы растворителей | Rf |
| 1 | Этилацетат – метиловый спирт – 25% раствор аммиака (85:10:5) | 0,0 |
| 2 | Хлороформ – ацетон – диоксан – 25% раствор аммиака (45-5-47,5-2,5) | 0,0 |
| 3 | Хлороформ – метиловый спирт (90-10) | 0,0 |
| 4 | Циклогексан – толуол – диэтиламин (75-15-10) | 0,45 |
| 5 | Метиловый спирт – 25% раствор аммиака | 0,1 |
Лучшее разделение наблюдали в системе растворителей циклогексан – толуол – диэтиламин (75-15-10).
В качестве проявителей использовали: 1) подкисленный раствор йодплатината; 2) реактив Драгендорфа в модификации Мольдавера; 3) последовательно 10% раствор сульфата меди (II) и 10% раствор аммиака; 4) 10% раствор гексацианоферрата калия (II).
Таблица 2. Результаты окрашиваний
| № пп. | Проявитель (реактив) | Окрашивание |
| 1 | Подкисленный раствор йодплатината | Коричневое |
| 2 | Реактив Драгендорфа в модификации Мольдавера | Оранжевое |
| 3 | Последовательно 10% раствор сульфата меди (II) и 10% раствор аммиака | Голубое, переходящее в пурпурно-красное |
| 4 | 10% раствор гексацианоферрата калия (II) | Белое |
Выполнение реакции окрашивания (реакция Сакагучи на гуанидин). К аликвоте извлечений при рН=9 при охлаждении во льду прибавляли 1 мл 5% раствора едкого натра и 2 капли 1% спиртового раствора а-нафтола. Затем прибавляли 10 капель раствора гипобромита (свежеприготовленный раствор 2 г брома в 100 мл 5% раствора едкого натра). Наблюдали появление красной окраски. В качестве контрольного раствора использовали извлечение при рН=9 из таблеток «Сиофор», «холостого» раствора – хлороформ [2].
Для идентификации метформина, выделенного из биологического материала и таблеток «Сиофор», снимали спектр поглощения остатков извлечений из щелочной среды в метаноле на спектрофотометре HP «Хьюлетт-паккард» в интервале длин волн 220-400 нм в кювете с толщиной слоя 10 мм. Наблюдали максимум поглощения метформина при 236 нм.
Идентификацию метформина (рис. 1) методом высокоэффективной жид-костной хроматографии проводили на хроматографе фирмы «Agilent Technologies» 1100 Series со спектрофотометрическим детектором на стандартной колонке из нержавеющей стали длиной 25 см с диаметром 4,6 мм, заполненной обращенно-фазным сорбентом Zorbax SB-С 18 (5 мкм). Температура колонки 25 °С. В качестве подвижной фазы был выбран раствор 0,01 М ацетата аммония в ацетонитриле в соотношении (35:65). Скорость элюирования 1 мл/мин. Детектирование проводили при длинах волн 220, 230, 236 и 254 нм. Вводимая доза 20 мкл. Время выхода метформина гидрохлорида при длине волны 236 нм 3,165 минуты. Исследование аликвоты извлечений при рН=9 проводили при той же длине волны, время выхода составило 3,174 минуты.
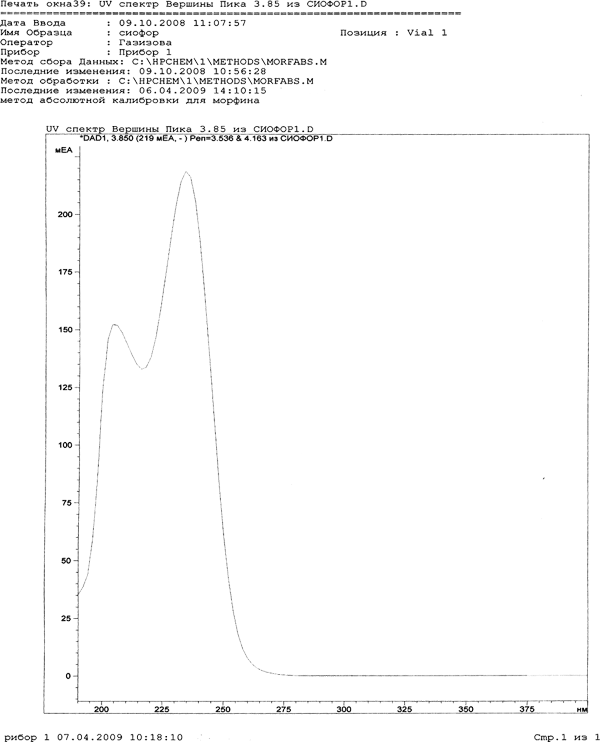
Рис. 1. Спектр метформина.
Согласно Кларку, минимально детектируемая концентрация метформина методом высокоэффективной жидкостной хроматографии в плазме 2,5 мг [4].
Выводы
- При судебно-химическом исследовании метформина целесообразно проводить изолирование биологического материала подкисленной водой с последующей идентификацией в извлечении при рН=9.
- Для идентификации метформина следует применять комплекс физико-химических методов исследования, включающий хроматографию в тонком слое сорбента, реакцию окрашивания, спектрофотометрию в ультрафиолетовой области, высокоэффективную жидкостную хроматографию. Использование метода ВЭЖХ повышает чувствительность определения метформина.
Список литературы
- Машковский М.Д. Лекарственные средства. – М., 1993. – 662 с.
- Р.Полюдек-Фабини, Т. Бейрих. Органический анализ. – Л., 1981. - 230 с.
- Jackson J.V., Moss M.S, Widdop B. // Clarke s isolation and identification of drugs. - London, 1986. - P. 740.
- Randall C. Baselt, Robert H. Cravey // Disposition of Toxic Drugs and Chemicals in Man. Chemical Toxicology Institute, California, 1995. - P. 470.

