Вы здесь
Определение теофиллина методом высокоэффективной жидкостной хроматографии (сб. Барнаул 08)
Publication in electronic media: 11.06.2009 under http://journal.forens-lit.ru/node/72
Publication in print media: Актуальные вопросы судебной медицины и экспертной практики, Барнаул-Новосибирск 2008 Вып. 14
А.В. Лаврентьева, А.Б. Мелентьев
г. Челябинск
Теофиллин (1,3-диметилксантин), алкалоид пуринового ряда, содержащийся в листьях чая и кофе, находит все большее клиническое применение из-за наличия широкого спектра фармакологического действия. Теофиллин уменьшает сократительную активность гладкой мускулатуры. Он расширяет бронхи, кровеносные сосуды, главным образом, сосуды мозга, кожи и почек. Уменьшает легочное сосудистое сопротивление, понижает давление в малом круге кровообращения. Оказывает спазмолитическое действие в отношении к периферической венозной системе, увеличивает почечный кровоток, обладает умеренно выраженным диуретическим эффектом. Угнетает агрегацию тромбоцитов. Препарат обладает стимулирующим действием на дыхательный центр, повышает частоту и силу сердечных сокращений.
Препарат применяют при бронхиальной астме для предупреждения приступов и для систематического лечения при хронических обструктивных заболеваниях легких, хронических бронхитах, эмфиземе легких, легочных гипертензиях, расстройствах дыхания по типу Чейн-Стокса (Справочник Видаль, 1995), а также как мочегонное средство при застойных явлениях сердечного и почечного происхождения (Машковский М.Д., 1984).
Действие на центральную нервную систему прямо зависит от дозы введенного препарата и может проявляться усталостью, беспокойством, тремором и даже конвульсиями при относительно больших дозах (Вартанян Р.С., 2005).
Для определения степени воздействия препарата на организм при терапевтическом мониторинге или токсикологическом анализе необходимо количественное определение теофиллина в крови. Узкий интервал терапевтических концентраций в крови (10 - 15 мкг/мл), а также близость токсической концентрации (от 30 мкг/мл) (Pharmaceutical Press, 2004) обусловливают актуальность терапевтического и токсического мониторинга этого препарата в крови.
Целью данной работы явилась разработка методики количественного определения теофиллина в крови с использованием в качестве внутреннего стандарта 8-хлортеофиллина методом ВЭЖХ, предназначенной для терапевтического мониторинга и токсикологического анализа.
Материалы и методы исследования
Оборудование. Жидкостной хроматограф с диодно-матричным детектором Agilent Technologies 1200 с колонкой Eclipse XDB-C18, длиной 150 мм, внутренним диаметром 2,5 мм и размером частиц фазы C18 5мкм. Встряхиватель АВУ-6, центрифуга СМ-6М, термоблок ПЭ-4030, набор пипеток-дозаторов фирмы Biohit.
Материалы и реактивы. В качестве исходного раствора анализируемого вещества использован ампулированный 2% раствор лекарственного препарата теофиллина производства ОАО Новосибирский химфармзавод. Использовали также порошок 8-хлортеофиллина фирмы Alfa-Aesar, н-бутанол, хлороформ, уксусную кислоту ХЧ и деионизированную воду.
Внутренний стандарт. Стандартный раствор 8-хлортеофиллина с концентрацией 5 мг/мл готовили растворением 50 мг порошка (8-хлортеофиллина) в 5,05 мл этанола с добавлением 4,95 мл 0,1Н раствора гидроксида натрия. Рабочий раствор с концентрацией 8-хлортеофиллина 1 мг/мл готовили добавлением во флакон с 3,2 мл воды 0,8 мл стандартного раствора 8-хлортеофиллина с концентрацией 5 мг/мл.
Стандартные и калибровочные растворы. Рабочий раствор теофиллина в этаноле с концентрацией 5 мг/мл готовили добавлением во флакон 1,25 мл исходного раствора теофиллина и 3,75 мл этанола. Рабочий раствор с концентрацией теофиллина 1 мг/мл готовили добавлением во флакон 1 мл раствора теофиллина с концентрацией 5 мг/мл и 4 мл этанола. Для приготовления калибровочных растворов использовали схему, приведенную в табл. 1. К 1 мл «холостой» крови добавлялось соответствующее количество одного из рабочих растворов (табл. 1). После этого калибровочные пробы проходили все процедуры пробоподготовки и анализа. По результатам анализов калибраторов строилась калибровочная кривая.
Таблица 1.
Приготовление образцов для построения калибровочной кривой.
| № п/п | Название пробы | Калибровочная концентрация в крови, мкг/мл | Концентрация рабочего раствора, мг/мл | Объём рабочего раствора на 1 мл крови, мкл |
| 1 | Бланк | 0 | 0 | 0 |
| 2 | Точка 1 | 5 | 1 | 5 |
| 3 | Точка 2 | 10 | 1 | 10 |
| 4 | Точка 3 | 30 | 5 | 6 |
| 5 | Точка 4 | 100 | 5 | 20 |
| 6 | Точка 5 | 200 | 5 | 40 |
Подготовка крови для анализа. Для исследований и отработки методики использовали трупную кровь, проверенную на отсутствие теофиллина (менее 1 мкг/мл). До анализа образцы холостой и анализируемой крови хранили в морозильной камере при температуре минус 12°С. Подготовку крови проводили по следующей методике: к аликвотной части 1 мл крови добавляли 20 мкл рабочего раствора внутреннего стандарта (8-хлортеофиллина с концентрацией 1 мкг/мл), 1 мл 1Н раствора дигидрофосфата натрия (pH=4,3) и 5 мл смеси хлороформ : н-бутанол (9:1), смесь перемешивали 10 мин на встряхивателе и центрифугировали 10 мин при 3500 об/мин. Нижний слой органического экстракта отделяли и пропускали через слой безводного сульфата натрия. Растворитель испаряли досуха в потоке воздуха при температуре 40-50°С. Образец перед анализом растворяли в 500 мкл деионизированной воды.
Хроматографический анализ. Условия анализа: температура колонки - 40°С. Поток элюента 0,25 мл/мин. Элюирование градиентное, начальная мобильная фаза состояла из 0,01% уксусной кислоты и метанола (80:20), к 10 минуте объемное соотношение раствора кислоты и метанола в элюенте составляло 50:50. Восстановление колонки после анализа (post time) 5 мин. Аналитическая длина волны 270 нм, ширина щели 8 нм.
Правильность и воспроизводимость методики определяли по результатам анализа двух серий проб по 6 образцов каждая, содержащих по 10 и 100 мкг/мл теофиллина.
Результаты и их обсуждение
В качестве внутреннего стандарта для анализа теофиллина (рис.1 а) выбран 8-хлортеофиллин (рис.1 б), так как соединения имеют близкие физико-химические свойства, что обеспечивает их одинаковое поведение при экстракции и хроматографическом анализе.
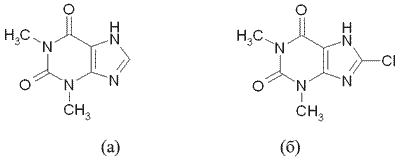
Рис. 1. Структурные формулы теофиллина (а) и 8-хлортеофиллина (б)
Хроматографические пики получаются острыми и хорошо воспроизводятся (рис. 2), что обеспечивает хорошую сходимость анализов и низкий предел обнаружения теофиллина. При выбранных условиях пробоподготовки и анализа предел обнаружения теофиллина составляет 0,2 мкг/мл крови. Предел обнаружения определяли методом добавок к холостой крови как минимальная концентрация анализируемого вещества в крови, дающая отношение сигнал/шум более 4. В таблице 2 приведены метрологические характеристики описанного метода определения теофиллина.
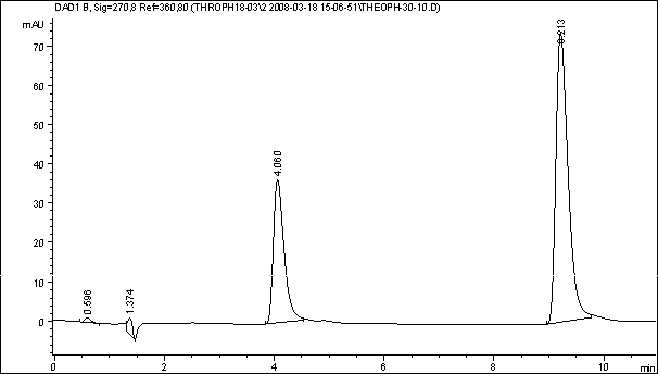
Рис.2. Хроматограмма контрольной крови с концентрацией теофиллина 10 мкг/мл (4,06 мин – теофиллин, 9,213 мин – внутренний стандарт).
Таблица 2.
Метрологические характеристики метода
| Предел обнаружения для теофиллина, мкг/мл | 0,2 | Предел количественного определения, мкг/мл | 5 |
| Линейность, мкг/мл | 5÷200 |
Калибровочная кривая для теофиллина линейна в диапазоне 5-200 мкг/мл и имеет вид:
Y = 29,4*Х + 4,1
R = 0,999,
где: Y - концентрация теофиллина в крови в мкг/мл; Х- отношение площадей пиков анализируемого вещества и внутреннего стандарта; R- коэффициент корреляции.
В табл. 3 приведены показатели воспроизводимости методики по анализу двух серий образцов.
Таблица 3.
Воспроизводимость методики определения теофиллина в крови (Р=0,95, n=6)
| Серия определений | Найдено, *мкг/мл | Sr | Найдено, **мкг/мл | Sr |
| 1 | 10,2 ± 0,4 | 0,051 | 101,2 ± 3,5 | 0,043 |
| 2 | 10,3 ± 0,6 | 0,074 | 100,7 ± 2,3 | 0,028 |
* Введено 10 мкг/мл (нижний контроль).
** Введено 100 мкг/мл (верхний контроль)
Описанная методика охватывает область от терапевтических до летальных концентраций теофиллина в крови. Она применяется в настоящее время для судебно-химических анализов в Челябинском областном бюро судебно-медицинской экспертизы, а также для токсикологических анализов и терапевтического мониторинга в Челябинском областном токсикологическом центре.
Список литературы
- Вартанян Р.С. Синтез основных лекарственных средств. М: МИА. 2005. - 845 с.
- Машковский М.Д. Лекарственные средства. В 2-х томах. Т.1. - 9-е изд., М.: Медицина, 1984. – 624 с.
- Справочник Видаль. Лекарственные препараты в России: Справочник. М.: АстраФармСервис. – 1995. – 1168 с.

